TruUCAR平台喜讯连连,亘喜生物在同种异体CAR-T细胞疗法领域取得临床新突破
收藏
关键词:
突破新突破
资讯来源:医药魔方 + 订阅账号
发布时间:
2022-02-23
近日,亘喜生物科技集团(简称“亘喜生物”;纳斯达克股票代码:GRCL),今天宣布其专有的、旨在开发高质量同种异体CAR-T细胞疗法的TruUCAR平台取得诸多进展。基于该平台,亘喜生物致力于打造一系列成本更低、使用更便捷的“即用型”同种异体CAR-T单药疗法。
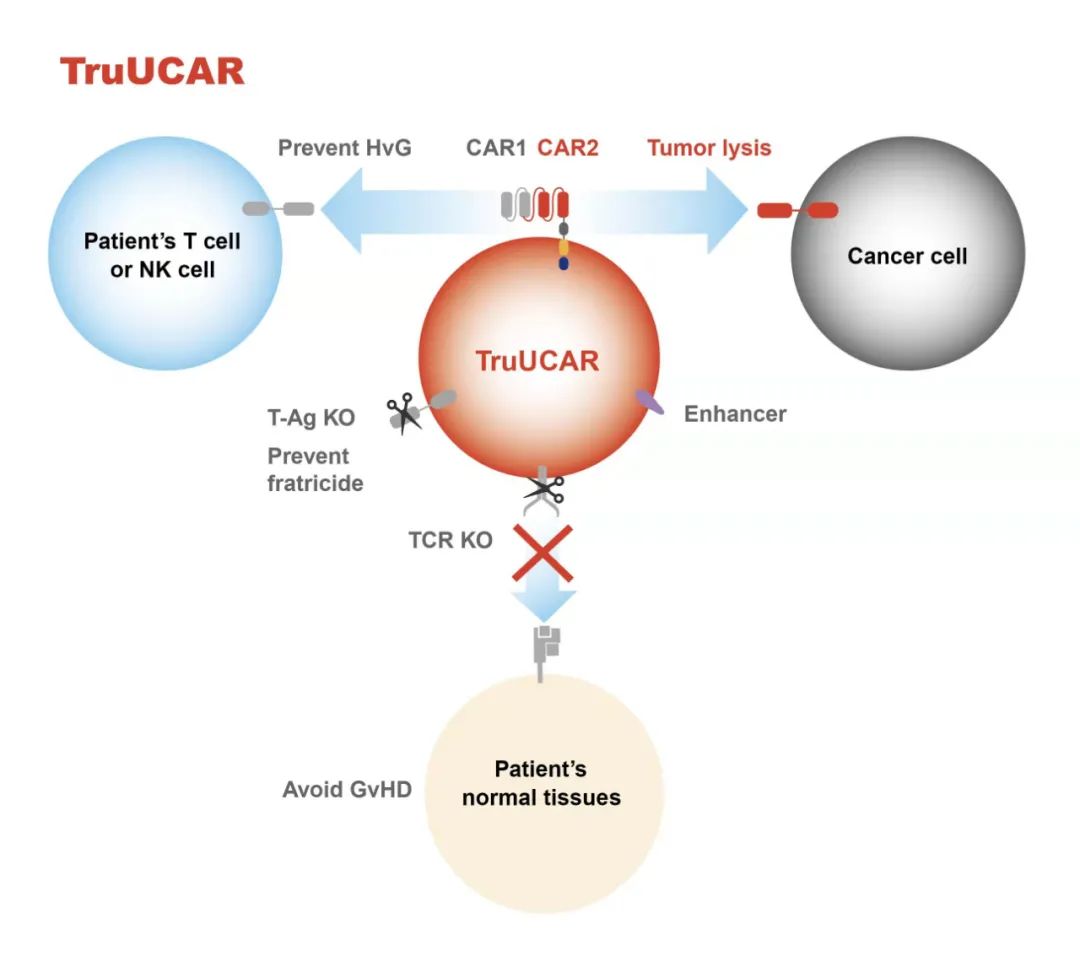
近期,基于TruUCAR平台开发的候选产品GC502针对复发/难治性急性B淋巴细胞白血病(r/r B-ALL)的首次人体临床试验数据摘要已被美国癌症研究协会(AACR)接受,亘喜生物将在位于路易斯安那州新奥尔良市举办的AACR 2022年会期间以海报形式公布数据详情。GC502是一种CD19/CD7双靶向同种异体嵌合抗原受体(CAR)T细胞疗法。目前,一项在中国开展的、由研究者发起的I期临床试验(IIT)正在评估其针对B细胞恶性肿瘤的功效。TruUCAR平台创新的双靶向CAR结构,能使细胞药物上的CD19 CAR特异性靶向恶性肿瘤细胞,同时CD7 CAR则用于抑制宿主抗移植物排斥反应(HvG)。这一独特设计赋予GC502成为一款单药疗法的潜力,使患者在成功清淋后,无需辅助额外的治疗以抑制HvG。
以
上摘要的完整标题将于美国东部时间
2022
年
3
月
8
日(星期二)下午
4:30
公布在
AACR
的线上议程页面(
AACR Online Itinerary Planner
),摘要内容则将于
2022
年
4
月
8
日(星期五)发布。
此外,基于TruUCAR平台开发的另一款候选产品GC027,是一种靶向CD7的即用型同种异体嵌合抗原受体(CAR)T细胞疗法,用于治疗急性T淋巴细胞白血病(T-ALL)成人患者。目前,GC027也正处于一项在中国开展的,旨在评估其安全性及有效性的由研究者发起的I期临床试验(IIT)。去年AACR年会期间,亘喜生物就已曾公布过GC027相关研究的初步数据,数据显示疗效优异、安全性良好。以上两款产品在临床研究阶段的积极进展,有助于进一步佐证TruUCAR平台技术在开发同种异体CAR-T细胞疗法方面的强大实力。
“源于TruUCAR平台的第二款候选产品GC502,治疗复发/难治性B-ALL的初步临床数据出炉在即。依托TruUCAR平台,亘喜生物致力于解决自体CAR-T疗法现存的一些挑战,包括因患者自身细胞质量而导致的可及性问题、疗法制备时间冗长、价格昂贵等。”亘喜生物首席医学官Martina Sersch博士表示:“随着两款候选产品在临床方面接连取得新突破,我们在开发同种异体CAR-T产品的道路上正昂首迈步,势头正盛;期待在今年的AACR年会上,向肿瘤学界分享更多GC502的数据详情,并在接下来汇总呈现GC027 IIT研究的最新成果。”
亘喜生物创始人、董事长兼首席执行官曹卫博士表示:“GC502是基于亘喜生物开创性的TruUCAR平台开发的第二款同种异体候选产品。 初步的临床证据让我们欣喜地看到,通过切换靶向不同肿瘤抗原的CAR结构,TruUCAR平台针对各类肿瘤适应症,展现出多样化的适用性,临床应用潜力巨大。展望未来,我们非常期待TruUCAR技术平台能不断结出硕果,打造出更多疗效卓越的即用型CAR-T细胞疗法。”
GC502是基于TruUCAR平台开发的CD19/CD7双靶向即用型同种异体CAR-T疗法候选产品。目前,该候选产品正处于
首次人体临床试验阶段
,主要针对B细胞恶性血液肿瘤。GC502使用来自无需人类白细胞抗原(HLA) 匹配的健康供者的T细胞进行制备。此外,该产品的设计中,亘喜生物还将一个增强型分子嵌入到TruUCAR的基础结构中,以提升TruUCAR T细胞的扩增能力。得益于同时靶向CD19/CD7的双CAR设计,以及在体内持久性方面的优化,GC502在临床前研究模型中展现出卓越的抗肿瘤活性,以及对宿主抗移植物(HvG)排斥反应的抑制效果。
急性淋巴细胞白血病(ALL)是一种以骨髓中未成熟淋巴细胞异常增殖为特征的恶性血液肿瘤,通常包括急性T淋巴细胞白血病(T-ALL)或急性B淋巴细胞白血病(B-ALL)。全球每年约有64,000名患者确诊ALL;2020年,美国和中国分别预计约6,000名和7,400名患者确诊ALL,其中B-ALL患者约占全体ALL患者总数的85%-88%。
GC027是一款首次用于人体试验、靶向CD7的即用型同种异体CAR-T疗法,针对性治疗T-ALL成人患者。该候选产品使用无需人类白细胞抗原(HLA)匹配的健康供者的T细胞进行制备。基于亘喜生物具有知识产权的TruUCAR平台开发,GC027利用双功能CAR设计,特异性靶向患者自身的T细胞和自然杀伤(NK)细胞,以防后者直接针对外源性或同种异体CAR-T细胞,引发患者的排斥反应。通过这一创新设计,GC027候选产品能在无需与额外的强效免疫抑制剂联用的情况下,在患者的免疫系统中存活,从而成为一种差异化的单药疗法。
T细胞恶性肿瘤是一系列与T淋巴细胞有关的癌症,包括急性T淋巴细胞白血病(T-ALL)。T-ALL的标准治疗包括放/化疗和干细胞移植。标准化疗方案只有30%-40%的响应率,且响应患者的中位总生存期为6个月。T细胞恶性肿瘤患者的复发率和死亡率通常都很高。复发患者预后较差,治疗选择极为有限,5年以上生存期不足10%。由于共有的表面抗原和潜在的恶性细胞污染,针对T-ALL的CAR-T细胞疗法发展滞后。另外,自2005年FDA批准奈拉滨(由GlaxoSmithKline完成商业化上市)以来,尚未有任何其他针对T-ALL的新疗法获批。全球每年约有64,000名患者确诊患有ALL;2020年,美国确诊患者数量约为6,000名。T-ALL患者约占所有ALL成人确诊患者的25%。
TruUCAR是亘喜生物具有知识产权的技术平台,旨在开发高质量的“即用型”同种异体CAR-T细胞疗法,进一步降低成本的同时,提供更好的便利性。TruUCAR通过基因编辑实现差异化设计,可在无需与免疫抑制性药物联用的情况下,分别控制宿主抗移植物排斥反应(HvG)和移植物抗宿主病(GvHD)。TruUCAR 创新的双CAR设计,能使针对肿瘤抗原的CAR杀伤肿瘤细胞,而针对CD7的CAR抑制宿主抗移植物反应,使TruUCAR T细胞得以成为一款单药使用的“即用型”同种异体CAR-T疗法。
亘喜生物科技集团(简称“亘喜生物”)是一家致力于发现和开发突破性细胞疗法的全球临床阶段生物制药公司。利用其开创性FasTCAR、TruUCAR以及SMART CART
TM
三大突破性技术平台,亘喜生物正在开发多项自体和同种异体的丰富临床阶段癌症治疗产品管线。这些产品有望攻克传统CAR-T疗法持续存在的重大行业挑战,包括生产时间长、生产质量欠佳、治疗成本高和对实体瘤缺乏有效治疗等。如需进一步了解亘喜生物,请访问www.gracellbio.com/

 药选址
药选址
