▎药明康德内容团队报道
7月27日,中国国家药品监督管理局药品审评中心(CDE)最新公示,Genmab公司、艾伯维(AbbVie)等公司已递交1类生物新药epcoritamab的临床试验申请,并获得受理。公开资料显示,epcoritamab是Genmab公司开发的一款靶向CD3/CD20的双抗疗法,艾伯维于2020年6月与Genmab公司达成合作,共同开发包括epcoritamab在内的多款差异化抗体类抗癌疗法。为此,艾伯维将支付给Genmab公司7.5亿美元前期付款,潜在里程碑付款高达31.5亿美元。
双特异性抗体是一种能够与两种不同抗原特异性结合的抗体分子。这一特性的应用,带来了一种称为双特异性T细胞衔接蛋白(bispecific T cell engager,BiTE)的双抗疗法。这种抗体的一端与癌细胞表面的特异性抗体相结合,另一端与T细胞表面的CD3受体相结合。它们不但可以将T细胞募集到癌细胞附近,而且通过与CD3受体的结合,激活T细胞杀伤肿瘤。
Epcoritamab正是这样一款T细胞衔接蛋白。它的一端与B细胞表面的CD20抗原结合,另一端与CD3受体结合。
已有临床试验数据表明,在治疗滤泡性淋巴瘤(FL)患者的临床试验中,epcoritamab能够达到86%的客观缓解率(ORR)。在治疗弥漫性大B细胞淋巴瘤(DLBCL)的患者中也达到了50%的ORR,其中包括3名接受CAR-T疗法失败的患者。

2020年6月,艾伯维与Genmab公司联合宣布,双方达成广泛
,以共同开发后者3款下一代双特异性抗体产品,包括其主打候选双抗疗法epcoritamab,DuoHexaBody®-CD37和DuoBody-CD3X5T4。同时,两家公司还将合作发现和开发其它差异化抗体类抗癌疗法。根据协议,艾伯维与Genmab公司将共同负责epcoritamab在美国和日本的商业推广,该产品在全球其他市场的开发和推广,则由艾伯维负责。
此次epcoritamab在中国申报临床,意味着这款产品也即将在中国开展临床试验。ClinicalTrials.gov网站显示,目前epcoritamab正在全球开展5项临床试验。其中,包括一项在复发、难治性弥漫性大B细胞淋巴瘤患者中开展的开放标签、随机、多中心、3期临床试验。
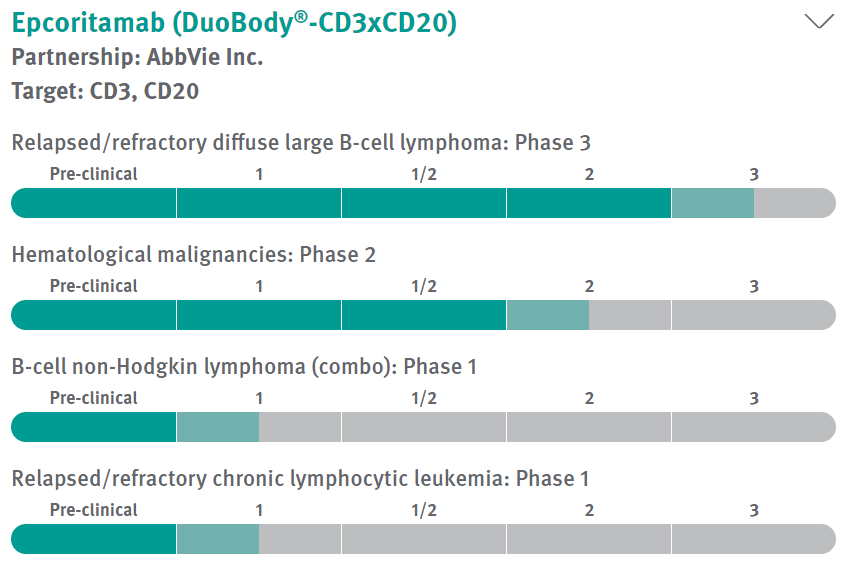
▲Epcoritamab研发进展(图片来源:参考资料[3])
希望epcoritamab这些临床研究进展顺利,并早日取得积极进展,为更多癌症患者带来全新的治疗选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]
中国国家药监局药品审评中心(CDE). Retrieved Jul 27,2021, from
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25
[2] Genmab and AbbVie Announce Broad Oncology Collaboration. Retrieved June 10, 2020, from https://ir.genmab.com/news-releases/news-release-details/genmab-and-abbvie-announce-broad-oncology-collaboration
[3] "Genmab & AbbVie, A Broad, Foundational Oncology Collaboration ". Retrieved June 10, 2020, from https://ir.genmab.com/static-files/cd214f3c-0bde-4553-893c-df15dfcf4755
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。








 个人中心
个人中心
 我是园区
我是园区




