
点评 | 徐彦辉(复旦大学)
维持能量水平来驱动运动和物质交换是生命的基本原则之一。AMP-activated protein kinase
(AMPK)
能够感受细胞内ATP/AMP/ADP水平,在低能量供给条件下,AMPK磷酸化下游底物,减少ATP的消耗,促进ATP的合成,是细胞内维持能量平衡至关重要的开关。经典的AMPK为异源三聚体,由催化亚基AMPKα、支架蛋白AMPKβ和调节亚基AMPKγ组成。AMPKγ的Bateman结构域能够结合ATP/AMP/ADP,并根据其比例不同导致复合物构象改变,调节AMPKα活性。
2022年11月15日,浙江大学生命科学研究院赵斌课题组与冯新华课题组、中科院药物所谭敏佳课题组合作在Molecular Cell上发表题为
Energy sensor AMPK gamma regulates translation via phosphatase PPP6C independent of AMPK alpha
的研究论文。这一研究通过比较AMPKγ和AMPKα敲除细胞、采用串联亲和纯化、以及磷酸化蛋白质组学分析等方法,
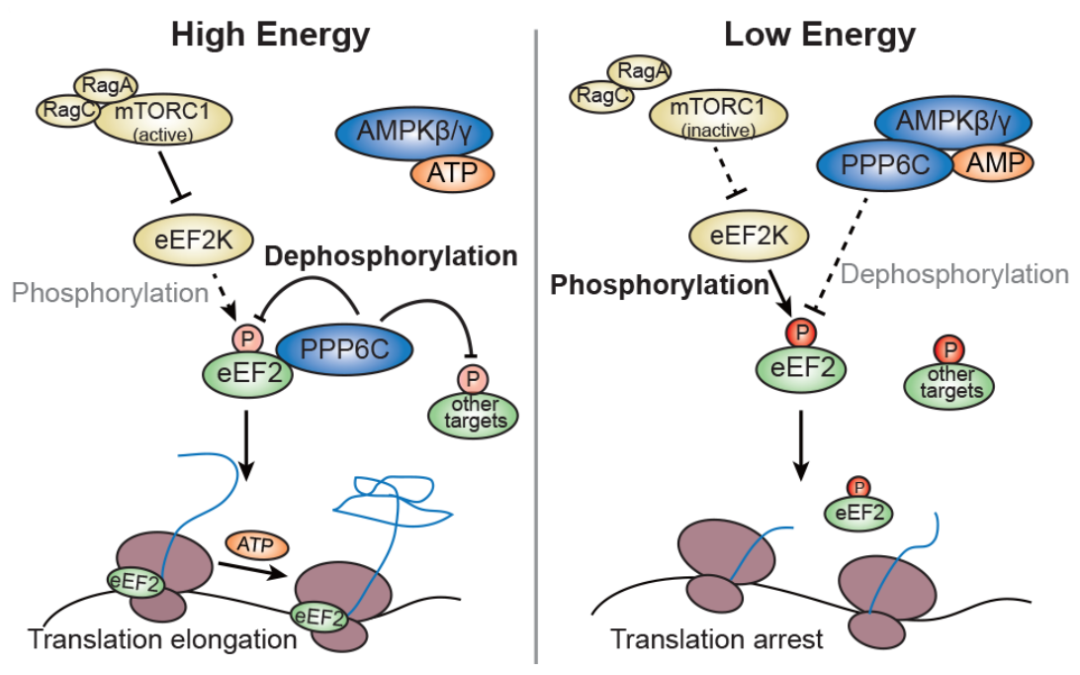
揭示了能量感受器AMPKγ可独立于经典的效应亚基AMPKα,调控磷酸酶PPP6C,进而影响其下游底物,例如eEF2的磷酸化,因此介导了细胞能量水平对蛋白质合成的调控。
该研究通过分析葡萄糖饥饿处理后AMPKγ和AMPKα敲除细胞经典下游底物磷酸化水平发现,以前被认为间接受AMPKα激酶调控的eEF2磷酸化在AMPKγ敲除后下降,但在AMPKα敲除后反而上升。进一步研究表明,AMPKγ可以调控eEF2的去磷酸化。通过磷酸酶文库筛选,鉴定出七个在过表达条件下可以去磷酸化eEF2的磷酸酶,但是在内源水平只有PPP6C的敲减明显导致eEF2磷酸化上升,并且被葡萄糖饥饿所调控。同时,通过对AMPKγ的串联亲和纯化分析发现,AMPKγ能够与PPP6C结合,并且这一结合受到能量水平调控。体内外结果显示,能量缺乏促进AMPKγ和PPP6C的结合,进而抑制PPP6C与eEF2的结合。对野生型和PPP6C敲低细胞在能量应激状态下SILAC磷酸化蛋白质组学定量分析显示,除eEF2外,还有其它磷酸化位点受到类似调控。进一步验证表明,葡萄糖饥饿还能通过AMPKγ-PPP6C调控HSPB1
(S82)
和PCM1
(S93)
的磷酸化。
细胞能量水平通过AMPKγ-PPP6C调控蛋白质合成模式图
综上所述,
该研究首次提出能量感受器AMPKγ还具有独立于AMPKα以外的其它效应分子,例如磷酸酶PPP6C。能量应激失调是代谢综合征和癌症等疾病的重要原因。因此,AMPKγ-PPP6C调控的蛋白质去磷酸化可能在这些疾病中也发挥重要作用。
浙江大学生命科学研究院赵斌课题组周琦、中科院上海药物研究所谭敏佳课题组郝兵兵为本文的共同第一作者。通讯作者为赵斌教授、谭敏佳研究员和冯新华教授。该工作还得到了陈帅、叶存奇等合作实验室的大力支持。
起于青萍之末的精彩
科学研究的魅力之一在于意料之外,情理之中,合于道。赵斌团队的研究成果正是这一类型研究的典范。
我们知道维持AMP-activated protein kinase (AMPK) 信号通路能够感受细胞内ATP/AMP/ADP水平,调控细胞内的能量稳态,是最基本的细胞生命调控过程。在低能量(高AMP水平)情况下,AMPK激活并磷酸化一系列下游底物,减少ATP的消耗,反之受到抑制。AMPK异源三聚体包含α(激酶亚基),β(支架蛋白)和γ(结合ATP/AMP的调节亚基),虽然功能各异,传统认为都是对AMPK功能所必须的。
赵斌团队在AMPKα双敲除和AMPKγ三敲除的检测中,发现传统认为的AMPK底物eEF2磷酸化的完全相反的效应,既AMPKγ敲除后磷酸化下降,但在AMPKα敲除后反而上升。实验室中经常会出现看似不合理的现象,如果排除了体系和实验条件的问题,可以稳定的重复,是否意味着是新发现的线索呢?背后的机制是否具有普遍性还是仅仅在非常小的范围内适用?是否有价值追踪下去?是考验科研工作者的专业水平和勇气的。
赵斌团队在验证了该现象的可重复性的基础上,继续深入开展研究,逐步梳理出清晰的脉络。发现AMPKγ具有独立于经典AMPK复合物的功能,可在能量限制的情况下,结合并抑制磷酸酶PPP6C活性,抑制包括eEF2底物在内的去磷酸化(既维持磷酸化),使eEF2无法支持蛋白质翻译,进而限制能量消耗。
蛋白质磷酸化调控是关键和广泛存在的信号调控机制,人体中有五百多种蛋白质激酶催化磷酸化反应,有一百多种磷酸酶催化去磷酸化反应,二者共同响应不同的环境因素和信号刺激,以实现迅速的细胞状态调整和稳态维持,是生物体系长期进化的结果。从逻辑来看,激酶往往产生主动性信号响应,磷酸酶是反向过程,都需要精确的调控。比如eEF2受mTOR激酶复合物和PPP6C磷酸酶共同作用以达到磷酸化的动态平衡,在能量限制情况下,AMPKγ抑制PPP6C确保eEF2磷酸化的稳定存在,其实现的功能是与AMPK复合物相一致的。
赵斌教授长期从事细胞关键信号通路的研究,早期在Hippo信号通路领域做出了多个里程碑式的发现(其中两篇论文他引超2千次),近期利用大量小鼠模型系统性地研究了多种信号通路在肝癌发生发展中的作用,发现了不同通路在肿瘤增殖、代谢及免疫中的独特功能。祝贺赵斌教授团队在细胞信号通路领域取得又一重要突破!
https://doi.org/10.1016/j.molcel.2022.10.030
制版人:十一

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。











 个人中心
个人中心
 我是园区
我是园区





