专家点评Cell Research | 汪源/陈路/张燕组揭示恶性胶质瘤发生路径和潜在早期诊疗时间窗口
收藏
关键词:
揭示诊疗Cell瘤
资讯来源:BioArt + 订阅账号
发布时间:
2021-01-05
点评 | 刘冲(浙江大学),王晓群(中科院生物物理所)
胶质母细胞瘤
(Glioblastoma,GBM)
是发病率和致死率最高的原发性脑肿瘤,具有高度异质性和放化疗抗性,治疗后中位生存期仅为十五个月。GBM预后极差的一个重要原因是缺乏有效的早期诊断和干预手段。超过90%的GBM属于原发型GBM
(primary GBM)
,诊断时已是终末期,临床上观测不到癌前病变或低等级肿瘤,但基因组数据推算在确诊前2-7年GBM起源细胞就已开始发生恶性转变。Luis Parada/Sheila Alcantara Llaguno、Yuan Zhu/汪源、Hui Zong/刘冲等团队通过多种转基因小鼠模型证明,GBM最可能的起源细胞是侧脑室下区
(Subventricular zone, SVZ)
神经干细胞
(Neural stem cell, NSC)
和脑实质中广泛存在的少突胶质细胞前体
(Oligodendrocyte precursor cell, OPC)
【1-4】
。2018年的一项研究发现GBM患者SVZ细胞存在低水平驱动突变,突变类型与远端肿瘤细胞一致,进一步支持了从人神经干细胞
(human NSC, hNSC)
到GBM的演化路径
【5】
。但hNSC在肿瘤发生进程中如何动态演化形成高度异质的GBM长期处于黑盒子状态,也不清楚是否存在一个时间窗口可以对GBM进行早期诊断和预防性治疗。
由于关注的是肿瘤形成前的生物学过程,此方面研究面临两方面技术挑战。首先,与结直肠癌等易于进行早期取样的肿瘤不同,原发型GBM在临床上无法观测到早期病变,难以获得早期样本进行分析。其次是缺乏理想的临床前动物模型。领域内广泛应用的病人源异种移植
(Patient-derived xenograft, PDX)
模型
(包括胶质瘤干细胞移植模型)
反映的是终末期肿瘤的性质。而现有的GBM转基因小鼠模型由于存在人鼠肿瘤差异以及成瘤位置的不确定性,对于模拟和分析hNSC的成瘤路径也不够理想。
2021年1月4日,四川大学华西医院生物治疗国家重点实验室汪源/陈路/张燕组课题组在Cell Research 杂志在线发表题为“
Sequential fate-switches in stem-like cells drive the tumorigenic trajectory from human neural stem cells to malignant glioma
”的研究论文。
该研究中,
作者通过基因编辑敲除hNSC中GBM相关抑癌基因成功构建了多个高成瘤率的恶性胶质瘤新模型。
这些模型很好的模拟了患者 GBM的病理和分子特征。通过多组学时序分析,作者在多时间点、多层次、单细胞精度揭示了hNSC在体内发生恶性转化形成肿瘤的全景图谱,确立了时间点特异的动态转录调控机制,发现了一系列新的潜在促瘤因子并对其中的C1QL1进行了功能验证。通过构建肿瘤发生树和谱系追踪实验,作者发现了一种在成瘤过程中持续存在的NSC-like细胞,其在成瘤过程中发生多次命运转变,分时、依序产生不同的恶性谱系。在早期关键时间点针对这些细胞进行短时程靶向干预即可有效抑制肿瘤发生,证明存在潜在早期诊疗时间窗口。
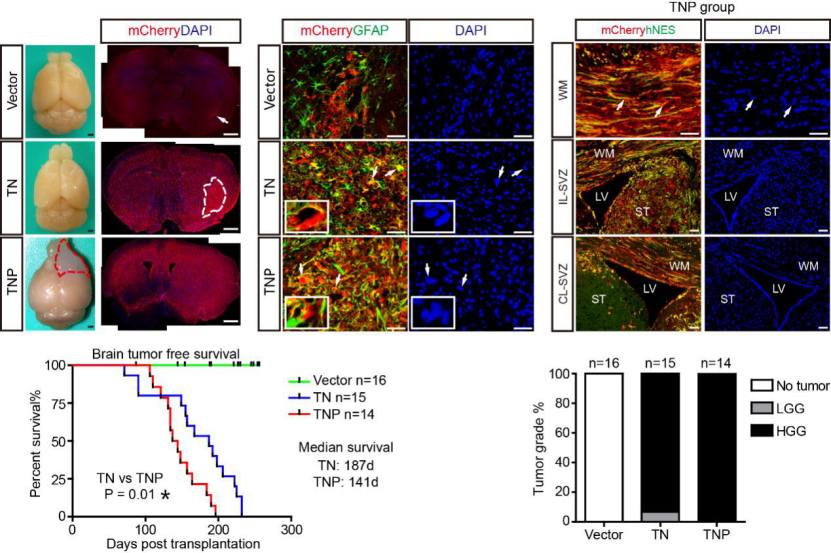
作者使用了一株可在多西环素诱导下稳定表达Cas9的人胚胎干细胞系iCas9-Hues8,将其向神经谱系诱导分化,建立了iCas9 hNSC细胞系。随后利用基因编辑在iCas9 hNSC中引入不同的GBM驱动突变组合和谱系追踪标记mCherry,再进行原位移植,构建了多种原位原发的恶性胶质瘤新模型。此类模型基因编辑效率很高,可以一次性引入多个驱动突变,不需要进行单克隆筛选即可形成肿瘤。其中,TP53/NF1双突变组合
(TN组)
恶性成瘤率94%,TP53/NF1/PTEN突变组合
(TNP组)
恶性成瘤率100%。终末期肿瘤大范围侵袭包括小鼠SVZ区在内的双侧脑区, 很好的模拟了GBM的病理特征。组织转录组和单细胞转录组分析表明,TN和TNP肿瘤在转录水平也模拟了GBM的分子特征和异质性。
为重建hNSC到恶性胶质瘤的成瘤路径,作者在肿瘤进程中的四个时间点
(T0:起始TNP hNSC细胞;T1:移植后一月;T2:移植后2月;End/End_SVZ: 终末肿瘤和肿瘤侵润的SVZ区)
进行多个体取样用于全外显子组、组织转录组和单细胞转录组测序,并在平行时间点收集了对照hNSC移植组数据。作者首先通过组织转录组分析拟合了对照hNSC的正常分化轨迹和突变hNSC的癌化轨迹,发现T2是两条轨迹的重要分歧点,大量胶质瘤相关基因在此时间点爆发式差异表达。组织切片染色也表明,T2期TNP细胞虽未形成终末期肿瘤,却相较T1期表现出更为明显的恶性特征。
作者进一步通过单细胞转录组分析构建了肿瘤发生树,发现了一群在肿瘤进程中持续存在、保持增殖的NSC-like细胞亚群。这些细胞在肿瘤发生树的分布提示其在成瘤过程中发生了多次命运改变,分时、依序产生神经元样
(Neuron-like)
、星形胶质细胞样
(AC-like)
和少突胶质细胞样
(OC-like)
细胞。三个时间段的BrdU体内谱系追踪实验证实了这些细胞的存在及其命运转变。有意思的是,各时间点全外显子组测序并未发现克隆水平的额外驱动突变或细胞命运调控因子突变,证明hNSC在获得所有必须的驱动突变后还需要经过复杂的命运决定机制才能形成肿瘤,其命运转变可能与体内微环境诱导的表观遗传改变有关,提示命运决定因子和驱动基因协同促进肿瘤发生。对GBM患者样本单细胞数据分析表明,GBM样本中也存在NSC-like细胞,不同GBM样本的NSC-like细胞分别表现出T1/T2、T2和End期特征,证明了前述发现的临床相关性。
作者通过Pseudotime拟时分析追踪了NSC-like细胞在成瘤过程中的分子演进并与王晓群组发表的发育期人脑海马单细胞数据进行比较
【6】
,发现了时间点特异的肿瘤发生调控网络和一系列新的潜在促瘤因子如C1QL1,并通过体外细胞实验和体内成瘤实验证明过表达C1QL1可以促进肿瘤形成。作者进一步针对NSC-like细胞成瘤过程中持续上调的AP-1基因,使用一种已进入临床二期的特异性靶向抑制剂T5224,在三个时间点对小鼠进行预防性给药10天,发现早期而非后期短时程靶向干预可以有效的抑制胶质瘤发生并显著延长小鼠生存期,证明存在潜在的早期诊疗时间窗口。
总的来说,
本研究确立了新的高效建模方法,并以此为基础全景式展示了从hNSC到恶性胶质瘤的癌化路径和细胞分子图谱,对理解GBM发病机制和异质性形成原理并在此基础上开发临床早期诊疗策略具有重要意义。
据悉,四川大学生物治疗国家重点实验室博士生王晓飞和
周冉
为论文的并列第一作者,四川大学生物治疗国家重点实验室/华西医院神经内、外科
汪源
研究员、华西第二医院/生物治疗国家重点实验室
陈路
研究员、生物治疗国家重点实验室/国家老年疾病临床医学研究中心
张燕
研究员为论文的共同通讯作者。
汪源研究员团队欢迎对肿瘤生物学、干细胞生物学、神经生物学和生物信息学感兴趣或有相关背景的助理研究员、博士后和研究生加入,有意者可联系
wangyuan@scu.edu.cn
。
高级别胶质瘤作为中枢神经系统最为常见的恶性肿瘤,预后差,临床上目前没有有效的治疗手段。针对胶质瘤治疗的挑战主要来自于其高度的肿瘤异质性与复杂的肿瘤细胞构成。而对于这一复杂的肿瘤构成是如何形成与演化的,目前仍不十分清楚。领域里近年来逐渐认识到,对高级别胶质瘤的治疗需要认识其发病机制和演化规律,这对于胶质瘤的早诊早治至关重要。
肿瘤的细胞起源研究是揭示肿瘤发病机制的重要方面。由于肿瘤发生的过程涉及到正常细胞在内源环境中的细胞行为变化及其与周围微环境的复杂互作,因此目前该类科学问题主要使用基因工程小鼠模型进行研究。然而,尽管动物模型具有完全模拟肿瘤发生的过程的无与伦比的优势,种属之间的差异导致其无法完全重现人源细胞的体内癌变过程。另一方面,尽管基于人多能干细胞
(hES)
和诱导性全能干细胞
(iPS)
分化的体外类器官肿瘤模型可以部分模拟在体外状态下肿瘤的发生,但这类模型缺少体内复杂的免疫等环境,因此其无法完全重现体内肿瘤的病理特征。
在这一期的Cell Research上,汪源课题组联合陈路、张燕课题组成功发展了基于小鼠和人源ES细胞分化的神经干细胞
(NSC)
作为细胞起源的“嵌合体”人胶质瘤发生的体内模型,并针对TP53/NF1和TP53/NF1/PTEN作为驱动突变的胶质瘤的演化路径进行了解析。这一工作是首次在体内环境下模拟并追踪突变人源NSC癌变的过程,对于胶质瘤致病机制的研究具有重要意义。该系统具有很强的扩展性,一方面可以用于产生不同突变类型的NSC以模拟各种突变产生胶质瘤的过程,另一方面可以通过改造受体小鼠
(如使用人源化免疫缺陷小鼠)
进一步研究肿瘤细胞与特殊免疫互作等重要问题。总体来说,该工作拓展了现有胶质瘤发生的模型工具,具有广泛的应用前景。
此研究使用了很多精巧的发育生物学分析工具和实验手段,从类似发育的视角去审视恶性胶质瘤的发生,提出了重要的问题
。比如在皮层神经发育过程中神经干细胞也发生了多次命运转变,其调控机制与神经干细胞癌化过程中的命运决定机制有何异同?神经干细胞在癌化过程中与成体脑内微环境细胞如何互作?这些问题都值得进一步探讨,而该工作建立的模型为探究这些问题提供了很好的基础。
https://doi.org/10.1038/s41422-020-00451-z
1.Wang, Y., et al., Expression of mutant p53 proteins implicates a lineage relationship between neural stem cells and malignant astrocytic glioma in a murine model. Cancer Cell, 2009. 15(6): p. 514-26.
2.Alcantara Llaguno, S., et al., Malignant astrocytomas originate from neural stem/progenitor cells in a somatic tumor suppressor mouse model. Cancer Cell, 2009. 15(1): p. 45-56.
3.Liu, C., et al., Mosaic analysis with double markers reveals tumor cell of origin in glioma. Cell, 2011. 146(2): p. 209-21.
4.Fan, X., Y. Xiong, and Y. Wang, A reignited debate over the cell(s) of origin for glioblastoma and its clinical implications. Front Med, 2019. 13(5): p. 531-539.
5.Lee, J.H., et al., Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature, 2018. 560(7717): p. 243-247.
6.Zhong, S., et al., Decoding the development of the human hippocampus. Nature, 2020. 577(7791): p. 531-536.




 药选址
药选址



