中国苏州、上海和美国加利福尼亚州帕罗奥图 ——近日,亘喜生物科技集团(纳斯达克股票代码:GRCL;简称“亘喜生物”) 宣布,美国食品药品监督管理局(FDA)授予其BCMA/CD19双靶点CAR-T细胞疗法孤儿药资格认定(ODD),该药物基于亘喜生物独有的FasTCAR技术平台开发,拥有“次日完成生产”的独特优势,目前正处于多项由研究者发起的I期临床试验,包括针对多发性骨髓瘤新发患者的研究。

关于孤儿药资格认定
孤儿药资格认定源自《孤儿药法案》(ODA),由美国食品药品监督管理局授予,初衷是为激励药企针对罕见疾病或病症(美国患者数少于20万人),开发更多安全、有效的创新药物。作为回报,荣膺孤儿药资格认定的申请企业,将有资格获得一系列特定的药物开发激励政策,包括:经监管部门批准后,享有最长达7年的市场专营权、临床测试相关的税收抵免、以及处方药使用者费用的减免等。
关于多发性骨髓瘤
多发性骨髓瘤是美国最常见的第三大恶性血液肿瘤,其肿瘤细胞起源于骨髓浆细胞,一种负责分泌抗感染抗体的免疫细胞。全球每年约有160,000名患者被确诊患有多发性骨髓瘤;2020年,美国预计确诊患者超过32,000名。近年来,虽然针对多发性骨髓瘤的治疗已取得诸多进展,但临床治疗效果依旧不尽如人意,尚无法达到治愈。
国际骨髓瘤工作组(International Myeloma Working Group, IMWG)和梅奥骨髓瘤分层与风险调适治疗(Mayo Stratification for Myeloma and Risk-Adapted Therapy, mSMART)共识指南等标准将存在特定细胞遗传学异常或其他异常的多发性骨髓瘤患者归类为高危患者,这部分人群在全部多发性骨髓瘤患者中占比达20-30%。高危患者的早期复发风险高,无进展生存期、总生存期较短,被认为是最难治疗的多发性骨髓瘤患者,通常预后较差。
关于GC012F
GC012F是基于FasTCAR平台开发的双靶向自体CAR-T疗法候选产品。目前,该候选产品正在一项由研究者发起的多中心、I期临床试验中评估其治疗多发性骨髓瘤的安全性和有效性,覆盖国内多个研究中心。GC012F通过同时靶向表达BCMA的恶性浆细胞位点和表达CD19的早期祖细胞位点,为多发性骨髓瘤患者带来快速、深入且持久的治疗效果。
关于FasTCAR
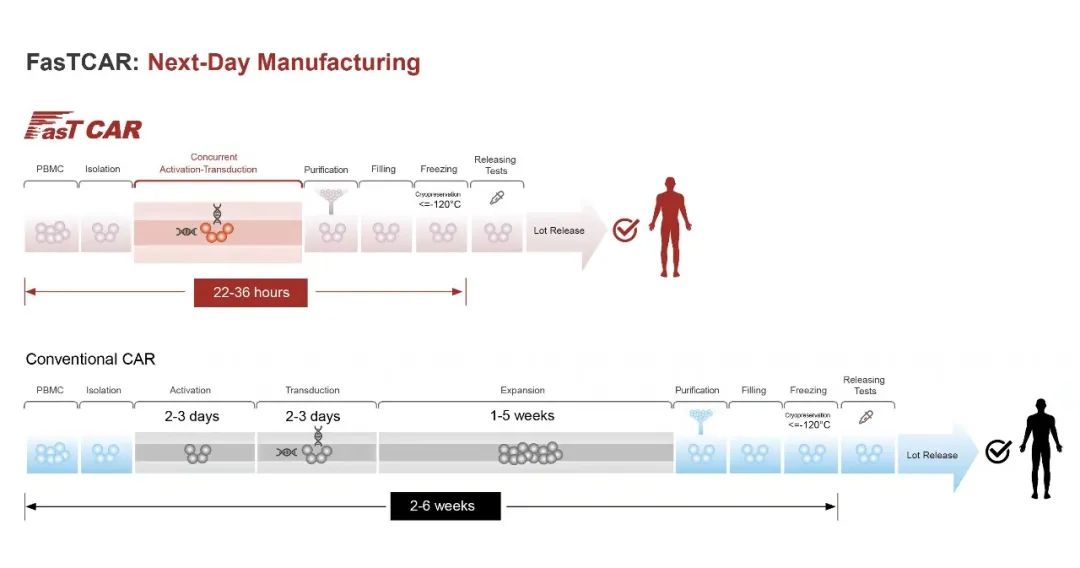
FasTCAR是亘喜生物具有知识产权的技术平台,旨在开发高质量的自体CAR-T细胞疗法。临床前研究显示,通过FasTCAR技术平台生产的CAR-T细胞表型更年轻、耗竭程度更低,并且扩增能力、持久性、骨髓迁移能力以及肿瘤细胞清除活性均得到增强。凭借“次日完成生产”的优势,FasTCAR平台技术能大幅提高细胞生产效率,从而显著降低生产成本,使细胞疗法能够惠及更多的癌症患者。
关于亘喜生物
亘喜生物科技集团(简称“亘喜生物”)是一家致力于发现和开发突破性细胞疗法的全球临床阶段生物制药公司。利用其开创性FasTCAR和TruUCAR技术平台,亘喜生物正在开发多项自体和同种异体的丰富临床阶段癌症治疗产品管线。这些产品有望攻克传统CAR-T疗法持续存在的重大行业挑战,包括生产时间长、生产质量欠佳、治疗成本高和对实体瘤缺乏有效治疗等。如需进一步了解亘喜生物,请访问www.gracellbio.com/关注领英账号@GracellBio。




 个人中心
个人中心
 我是园区
我是园区




