

导读:胃癌(GC)中的肿瘤微环境(TME)已被证明对肿瘤控制十分重要,但胃癌的具体特征尚未得到充分认识。研究人员在10名GC患者中生成了166,533个细胞的图谱,这些患者具有匹配的副肿瘤组织和血液。结果表明,肿瘤相关基质细胞(TASC)具有Wnt信号传导和血管生成的活性,并且与生存率呈负相关。肿瘤相关巨噬细胞和LAMP3 DC参与介导T细胞活性并与TASC形成细胞间相互作用中心。克隆型和轨迹分析表明,Tc17起源于组织驻留记忆T细胞,随后可以分化成耗尽的T细胞,这表明T细胞衰竭的替代途径。此外,IL17细胞可以通过IL17,IL22和IL26信号传导促进肿瘤进展,突出了靶向IL17细胞和相关信号通路作为治疗胃癌方法的可能性。
胃癌(GC)包括许多分子亚型,是全球第五大最常见的恶性肿瘤,估计2018年有783,000人因为胃癌死亡。虽然GC在早期原发阶段是可治疗的,但大多数患者在晚期或转移阶段被发现,预后相对较差。免疫疗法,特别是靶向PD-1和CTLA4的抗体,已经引起了各种癌症类型(如黑色素瘤)治疗的范式转变,但GC的反应率相对较低。最近,清华大学研究团队发布于《Nature Communications》的文章突出了靶向IL17细胞和相关信号通路作为治疗胃癌方法的可能性。

https://www.nature.com/articles/s41467-022-32627-z
单细胞RNA测序用于胃癌研究
01
最近,单细胞RNA测序(scRNA-seq)已成功用于破译GC的生态系统,解剖和发现潜在的肿瘤生物学。清华大学研究人员指出了原发性和转移性胃腺癌的转录异质性和谱系多样性,为诊断和预后提供了特征基因。同时,他们还描绘了GC发生和发展过程中巨大的细胞表型重塑,并确定了早期GC检测的制造者。此外,他们还得出弥漫型胃肿瘤中显示出浆细胞比例增加,并研究了癌症相关成纤维细胞中的INHBA-FAP轴。
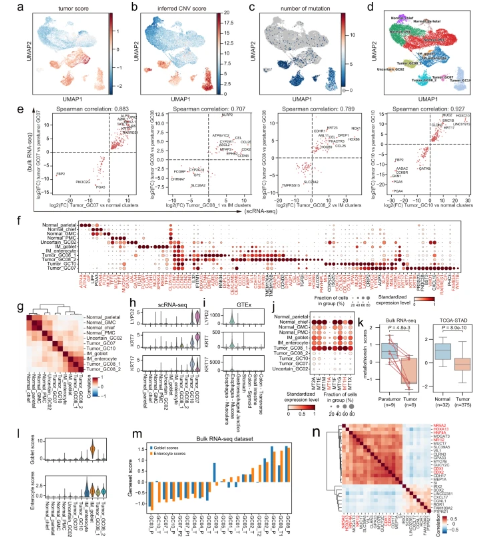
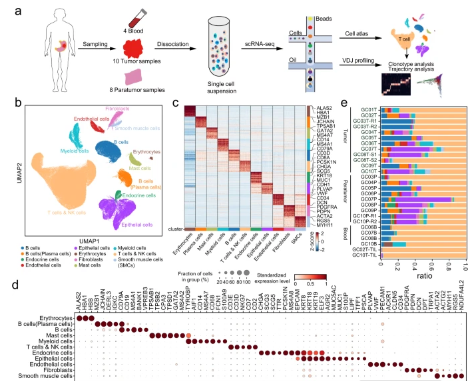
在这项工作中,研究人员应用scRNA-seq来绘制肿瘤,邻近正常组织和来自10名GC患者的匹配外周血中免疫,基质和上皮区室的转录景观,并结合T / B细胞受体库分析。结果表明,肿瘤组织中的基质细胞发生显着转变并表现出广泛的肿瘤促进特征。细胞通讯分析表明,TASC、TAMs和LAMP3DC是TME中复杂细胞相互作用的重要介质。结合TCR克隆型信息和轨迹分析,他们发现GC中的Tc17可能起源于组织驻留记忆群体,随后可以分化为疲惫状态,这表明T细胞衰竭的替代途径。研究结果表明,IL17细胞和介导IL17细胞与肿瘤细胞通讯的途径是治疗IL17阳性胃癌的潜在治疗靶点。
胃癌的综合单细胞转录组图谱
02
清华大学研究人员提出了GC的综合单细胞转录组图谱,其中描述了免疫,基质和上皮亚群的详细而复杂的分类,并进一步阐明了它们的分子特征和细胞间通讯。最明显的现象是TME中细胞组成的广泛重塑。抑制性Tregs,TASC,TAMs,Tc17和CD8耗尽的T细胞在肿瘤中富集,而肥大细胞,内分泌和滤泡调节性T细胞在副肿瘤中富集。值得注意的是,高比例的TASC与较差的预后有关。通过配体和受体分析,他们观察到TASC,Mφ_APOE和LAMP3 DC作为复杂细胞间相互作用网络中的关键介质,协调了免疫抑制微环境并促进了肿瘤进展。阻断这些相互作用,如IL34-CSF1R和TIGIT-NECTIN2轴,可能潜在地激活TME或启动TME,以提高GC中现有免疫疗法的疗效。
研究人员还观察到Tc17细胞可以通过细胞因子IL17,IL22和IL26促进肿瘤生长。然而,IL22和IL26在TCGA-STAD数据集的批量测序肿瘤样品中均以非常低的水平表达。如果Tc17细胞与肿瘤细胞物理相互作用,则可以解释这种差异,因此,尽管在肿瘤组织中表达总体较低,但Tc17细胞产生的细胞因子在上皮细胞附近的影响是深远的,突出了单细胞分析的力量。
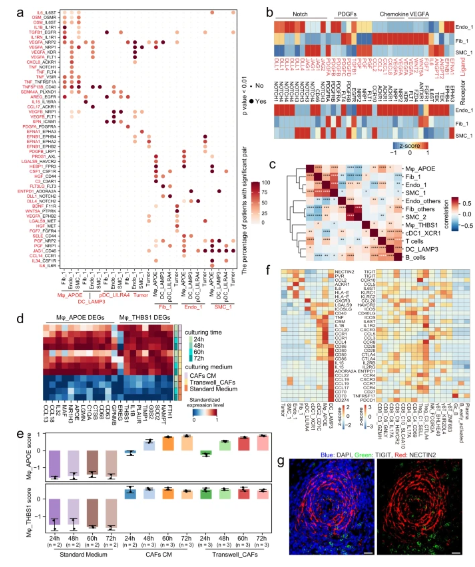
详细研究Tc17细胞和肿瘤细胞之间的相互作用也将成为未来研究的一个有趣的方向。研究证明Tc17细胞可能起源于组织驻留的记忆T细胞,并通过克隆型和RNA速度的分析分化成耗尽状态,除了T细胞的细胞溶解耗尽路径外,还描绘了另一种耗尽途径。此外,他们确定了TF是两个耗尽轨迹中的潜在关键监管机构。因此,假设可以使用CRISPR或RNAi操纵这些TF来诱导Tc17的过早终末衰竭,并拦截细胞毒性T细胞的衰竭过程。总之,研究结果强调了靶向IL17 T细胞或其前肿瘤信号传导(IL17 / 22 / 26)治疗IL17胃癌患者的治疗潜力。
局限和展望
03
总的来说,研究说明了GC的复杂生物学图景,阐述了细胞亚群与肿瘤进展之间的关联,并提出了一些有希望的肿瘤治疗线索。
然而,研究的一个局限性是患者人数少。因此,分析得出的结果是探索性的,应该在大规模的scRNA-seq队列中进一步验证。其次,scRNA-seq缺乏各种类型细胞的空间分布和染色质可及性的关键信息。未来,研究计划应用空间转录组学和scATAC-seq来剖析CellPhoneDB推断的这些相互作用细胞类型的位置关系,并研究TF在细胞状态重塑中的作用。研究人员发现,例如TASC的前肿瘤特征,应该在患者来源的异种移植物(PDX),患者来源的类器官(PDO)或其他模型系统中进一步验证和扩展。
参考资料:
https://www.nature.com/articles/s41467-022-32627-z
目前已有500+行业精英加入基因俱乐部
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区




