国内首款RET抑制剂!基石药业普拉替尼获批
收藏
关键词:
石药抑制剂制剂获批药药业
资讯来源:生物探索 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2021-03-24
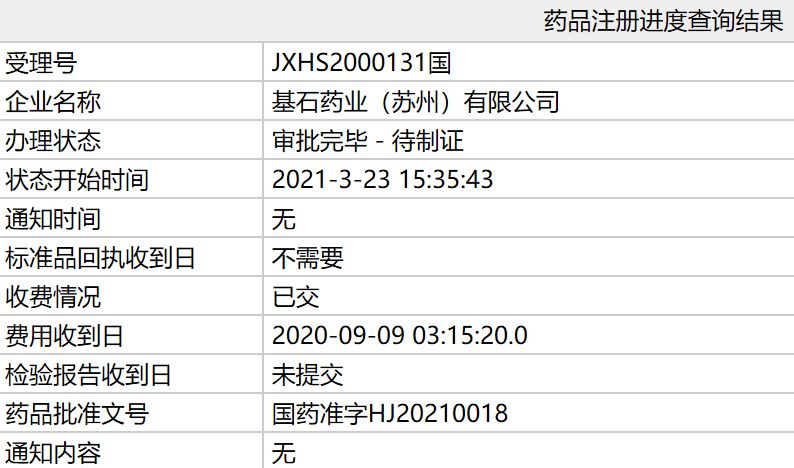
据国家药品监督管理局(NMPA)3月23日公示,基石药业RET抑制剂普拉替尼(pralsetinib)新药上市申请审评审批状态已更新为“审批完毕-待制证”,适应症为既往接受过含铂化疗的转染重排(RET)融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC),批准文号为:国药准字HJ20210018。这意味着该药已正式获批。
在当前国内尚无RET抑制剂获批上市的背景下,普拉替尼填补了这一空白,同时也成为基石药业获批的首个药物。
RET是一个在转化中发生重排的原癌基因,编码细胞膜受体酪氨酸激酶,研究表明,RET基因的突变、重排及缺失,与多发性内分泌腺瘤、乳突状甲状腺癌及先天性巨结肠密切相关。
普拉替尼是一种口服、每日一次、强效高选择性RET抑制剂。临床前研究中该药针对最常见RET基因融合、激活突变和预测耐药突变始终表现出次纳摩尔水平的效价。该产品最初由Blueprint Medicines Corporation依据其专有化合物库所设计得出的,基石药业获得了该产品在大中华区的开发和商业化权益的独家授权。
2020年,普拉替尼获得美国FDA批准用于3种适应症,分别是经FDA批准的检测方法检测证实为转移性RET融合阳性非小细胞肺癌的成年患者、需要系统治疗的12岁及以上晚期或转移性RET突变甲状腺髓样癌成人和儿童患者,以及需要系统治疗且放射性碘(如适用)难治的12岁及以上晚期或转移性RET融合阳性甲状腺癌成人和儿童患者。
2020年9月,基石药业宣布,普拉替尼用于经含铂化疗的RET融合阳性的NSCLC的新药上市申请获得CDE受理,并且随后被纳入优先审评范围。
在今年年初举行的第21届世界肺癌大会(WCLC)线上会议上,基石药业以口头报告形式公布了普拉替尼在全球I/II期ARROW关键性研究中的中国患者的研究结果。截止2020年5月22日,这项研究纳入了32位有可评估病灶的NSCLC中国患者,他们此前接受了至少一种铂类化疗方案。
接受每日一次400mg的普拉替尼治疗6个月后,无论患者的RET融合基因型如何,总体疾病控制率为97%,客观缓解率达到56%,包括1例完全缓解和17例部分缓解,这些18位患者从服药至首次缓解的中位时间为1.9个月。
值得一提的是,基石药业目前还有三款药物递交上市申请,分别是阿泊替尼、艾伏尼布和舒格利单抗。今年3月5日,基石药业与国药集团签署了战略合作协议,双方将携手推进阿伐替尼和普拉替尼在中国获批上市后的商业化进程。

[1] 基石药业官网
[2]祝贺!中国迎来首个RET抑制剂!基石药业精准抗癌药物「普拉替尼」获批
[3]基石药业RET抑制剂「普拉替尼胶囊」即将获批
[4]https://www.cnki.com.cn/Article/CJFDTotal-SHSW806.007.htm
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。
免疫疗法 | 生物仿制药 | 疫苗 | 耐药性 | 药物靶点 | 健康生活 | 药企新闻 | 药物盘点 | 制药技术 | 药物副作用
白血病
| 肺癌
| 胃癌
| 结直肠癌
| 肝癌
| 乳腺癌
| 胰腺癌
| 心血管疾病
| 神经退行性疾病
| 肠道微生物
体外诊断
| 医疗器械
| 生物纳米
| 3D打印
| 基因检测
| 单细胞测序
| 基因编辑
| 辅助生殖
| 人工智能
| 精准医学
抗癌药
| 4+7带量采购
| 耗材
| 备案制
| 注册人制度
| 健康中国
| 新版基药目录
| AI医疗器械
| 远程医疗
| 同股不同权
IPO
| 融资
| 合作
| 基金
| 港交所
| 科创板
| 创业板
| 研发投入
| 收购
| 市场&消费





 个人中心
个人中心
 我是园区
我是园区




