回望2020,中国国家药品监督管理局(NMPA)共获批13款创新药物。
这13款获批药物,10款国内创新产品,如此基调下,中国创新药的2021年必将会更加火热!
13款获批药物:
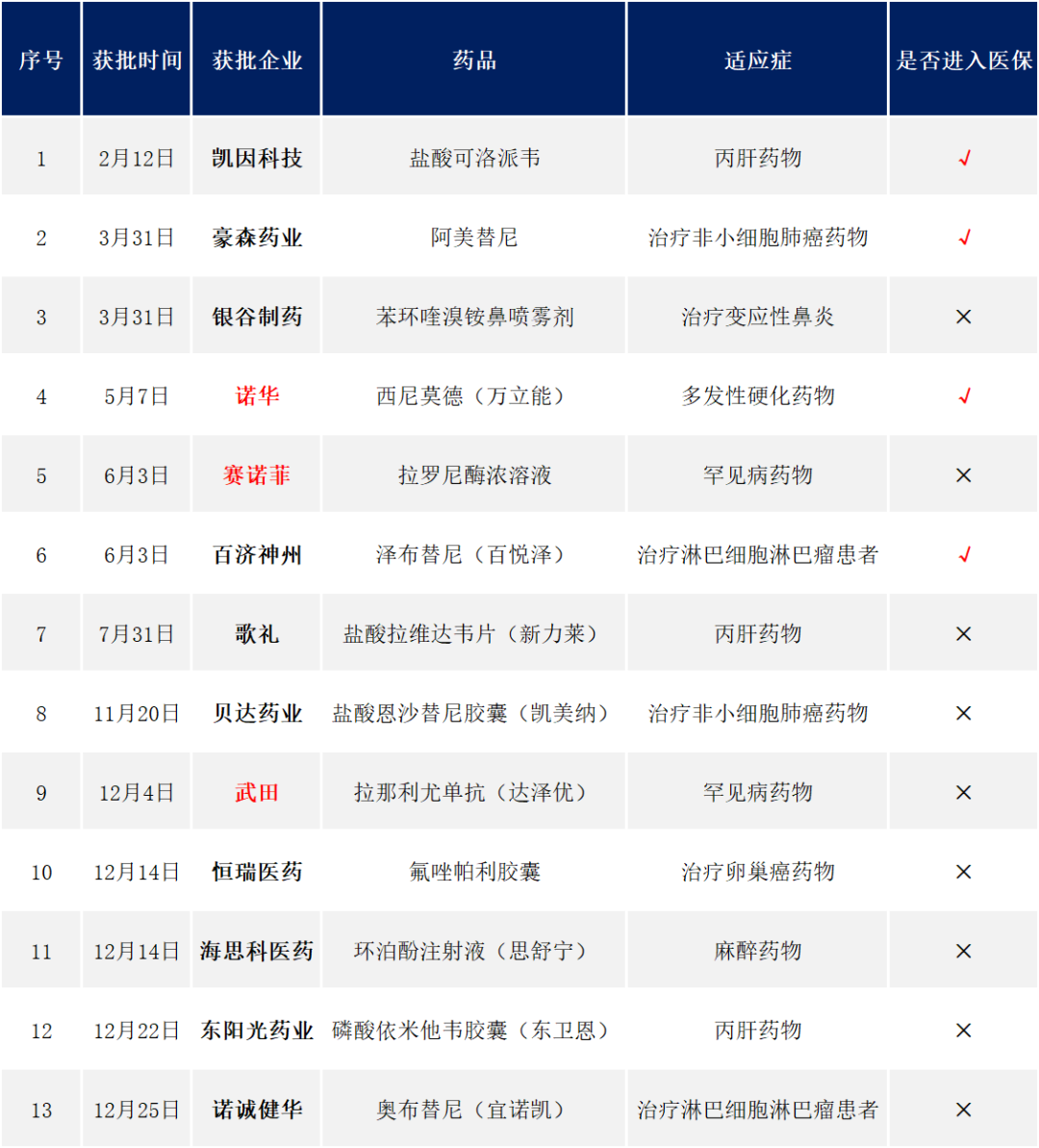
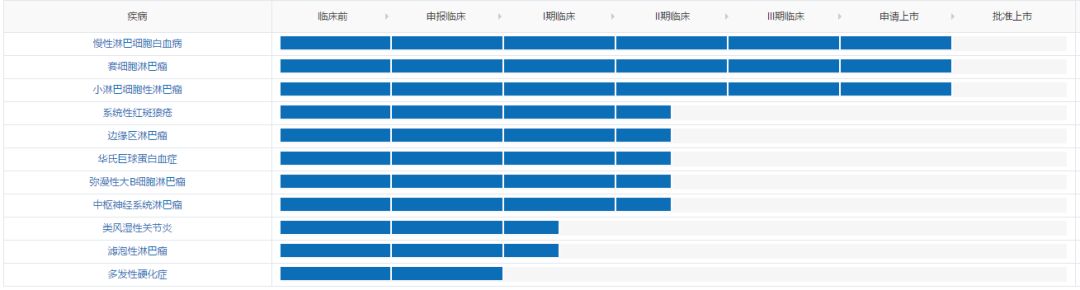
▲2020,NMPA获批的13款创新药物
①进入此次医保有 4个
凯因科技的盐酸可洛 —— 本次医保谈判唯一进入医保的丙肝药物
豪森药业的阿美替尼 —— 全球第二个获批上市的三代EGFR-TKI药物,直接 VS 阿斯利康的奥希替尼(泰瑞沙)
诺华多发性硬化口服药物西尼莫德 —— 实现全球同步上市,另外诺华此次医保进入7个,位居跨国药企Top1
百济神州泽布替尼 —— 首款获批的中国国产BTK抑制剂
②跨国药企获批 3家
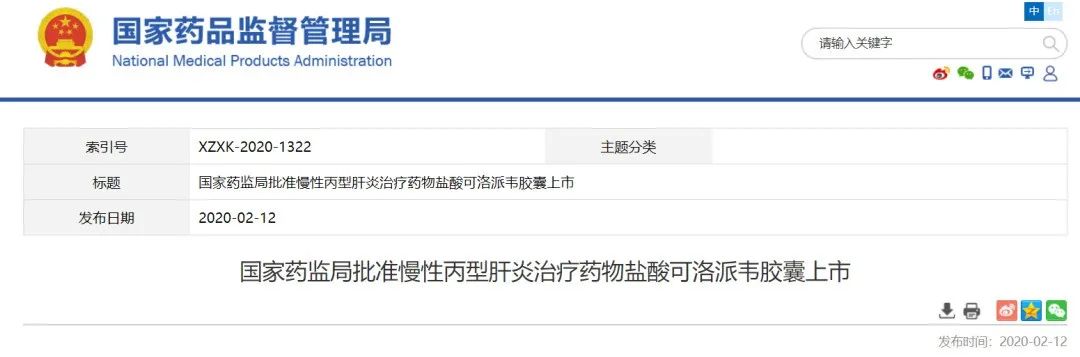
凯因科技获批丙肝药物
是本次本次医保谈判唯一进入医保的丙肝药物
刚刚落幕的医保谈判,丙肝药物中,凯因科技的盐酸可洛派韦力压吉利德的两款老牌丙肝药,成为本次医保谈判唯一进入医保的丙肝药物。
凯因科技打破了外企对国内丙肝治疗药物的垄断局面,实现进口替代。
盐酸可洛派韦是一种丙肝病毒非结构蛋白5A(NS5A)抑制剂,其与索磷布韦联用,可治疗初治或干扰素经治的成人慢性丙型肝炎病毒(HCV)感染。
*盐酸可洛派韦是一种丙肝病毒非结构蛋白5A(NS5A)抑制剂,极大地干扰丙肝病毒复制。
凯因科技是一家以生物技术为平台,专注于病毒性疾病领域的生物医药公司。公司以现有病毒病领域治疗药物的生产及销售为基础,同时积极开展创新药的研发。
产品线方面,目前,凯因科技现有已上市销售的产品主要包括
重组人干扰素 α2b :凯因益生®,金舒喜®
复方甘草酸苷药物:凯因甘乐®,甘毓®
值得一提的是,凯因科技的重组人干扰素 α2b产品 —— 凯因益生广泛用于新冠病毒治疗。
*凯因益生®是一种广谱抗病毒药物,能够抑制病毒复制,同时促进细胞毒性 T 细胞的增殖从而增强免疫力。
2020年初,疫情在全国爆发,α-干扰素被国家卫健委推荐作为抗病毒治疗试用药物之一,凯因益生在全国抗击新型冠状病毒病疫情防控一线被广泛应用,销量增长明显。
自1月20日起启动凯因益生®的紧急生产,至5月6日已发货超过160万支,其中向以武汉为主的湖北地区供应 40 余万支。
豪森药业获批抗癌药
全球第二个获批上市的三代EGFR-TKI药物
本次医保目录谈判,
豪森药业
的
阿美替尼
强劲的竞争对手是
阿斯利康
的
奥希替尼(泰瑞沙)。
*阿斯利康的奥希替尼早在两年前就已被纳入乙类医保,这也是此前唯一纳入中国医保的三代EGFR-TKI药物。
阿美替尼是继AZ奥希替尼后,全球第二个获批上市的三代EGFR-TKI药物。
而此次医保谈判中,阿美替尼再次降价64%,谈判价格为3520元/盒,相当于一年内降价82%。
而该药是在今天3月31日获得NMPA批准上市。
*用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
如今的豪森实现吗啉硝唑、氟马替尼、阿美替尼、聚乙二醇洛塞那肽4个1类创新药获批上市,30 个仿制药以首仿、抢仿获批,形成了中枢神经、抗肿瘤、抗感染及糖尿病四大优势治疗领域。
在打造国内创新药企的同时,豪森兼顾生产质量与国际接轨。
自2012年起,豪森的长春瑞滨注射剂、吉西他滨注射剂、艾替班特注射液先后获美国 FDA 批准上市。
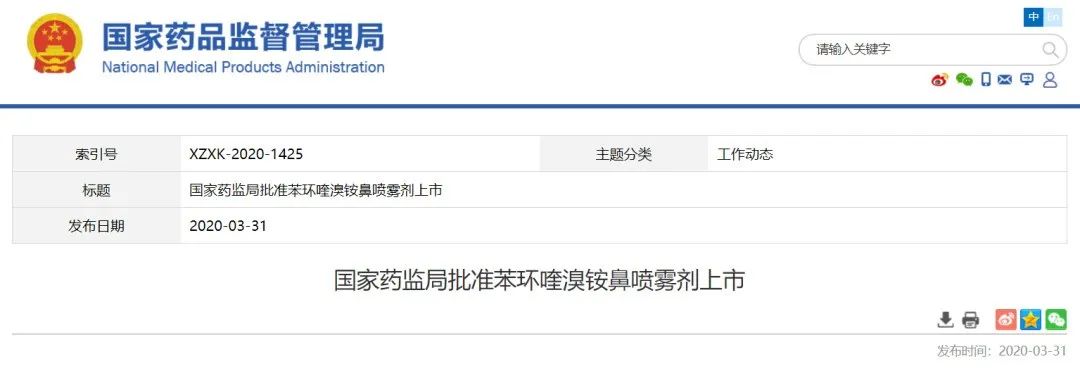
银谷制药获批苯环喹溴铵鼻喷雾剂
3月31日,NMPA宣布批准银谷制药1类创新药苯环喹溴铵鼻喷雾剂(商品名:必立汀)上市,用于改善变应性鼻炎引起的流涕、鼻塞、鼻痒和喷嚏症状。
银谷制药是一家从事创新药物研发、化学药品(原料药、注射剂、喷鼻剂)生产、新药全国销售市场拓展及销售的创新型制药企业。
目前已上市的产品有鲑降钙素注射液(固泰宁)及其鼻喷雾剂(金尔力)。
诺华获批发性硬化药物
全球第一能够对病情有进展的复发型多发性患者实现神经修复、延缓残疾进展的口服DMT药物
此次进入医保的也有诺华的多发性硬化口服药物
西尼莫德(商品名:万立能)
5月7日,诺华新一代多发性硬化口服药物西尼莫德5月7日在中国获批,实现了
全球同步上市
。
其是
全球第一能够对病情有进展的复发型多发性患者实现神经修复、延缓残疾进展的口服DMT药物
。
8月25日,诺华宣布西尼莫德在中国
开出首
张处方
,第一批药品已在北京、上海、广州等全国29个城市30多家医院全面落地。
赛诺菲获批罕见病药物
全球首个且目前唯一的MPSⅠ治疗特效药
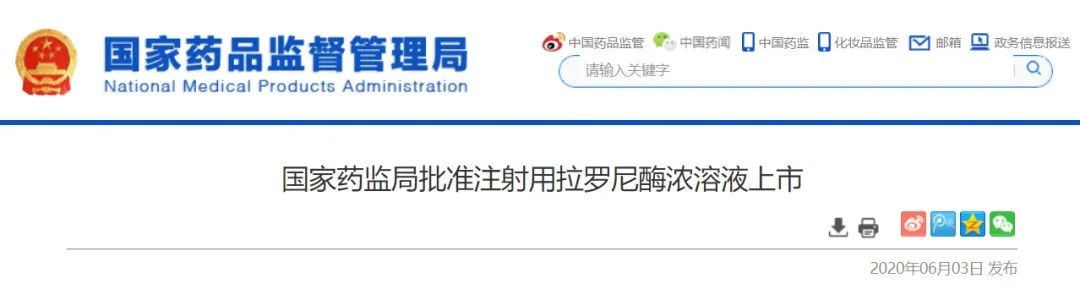
全球首个且目前唯一的MPSⅠ治疗特效药,为中国患者带来福音!
6月3日
,NMPA宣布批准赛诺菲的
注射用拉罗尼酶浓溶液
上市,适应症为黏多糖贮积症Ⅰ型患者的长期酶替代治疗,用于治疗疾病的非神经系统表现。
黏多糖贮积症(MPS)是一类罕见的遗传性疾病,
已被纳入中国《第一批罕见病目录》
。
自退出糖尿病领域后,赛诺菲王牌产品Lanuts又身陷专利悬崖,其开始主攻免疫炎症、疫苗、罕见病业务。
进入2020年,赛诺菲中国把重心转向专科药产品组合。这也是
今年,赛诺菲在中国获批的唯一一款罕见病药物
。
百济神州获批抗癌药
首款获批的中国国产BTK抑制剂
此次百济神州的泽布替尼
(商品名:百悦泽)
也进入医保。
其谈判前价格为176.6元/80mg/粒,适应症年治疗费用为25.8万元。
值得一提的是,泽布替尼是
首款获批的中国国产BTK抑制剂
。
*它的特点在于最大化对BTK靶点的特异性结合,从而最大程度减小脱靶效应而带来的毒副作用。
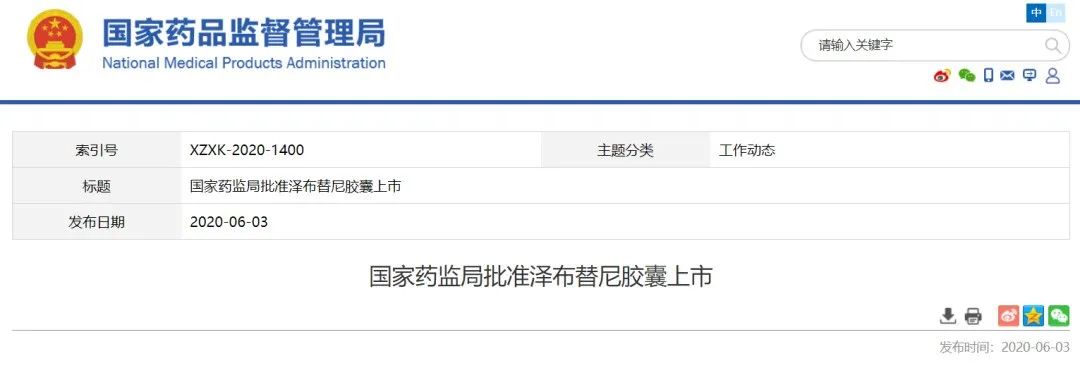
6月3日
,NMPA宣布附条件批准百济神州1类创新药
泽布替尼胶囊
上市,用于治疗的成人慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者。
目前,百济神州泽布替尼最大的竞争对手则是强生/艾伯维联合开发的伊布替尼,该产品是全球也是国内首个上市的BTK抑制剂,于2017年8月在中国获批。
*随后其通过谈判进入2017年国家医保乙类目录,中标价为189元/140mg/粒,CLL/SLL适应症年治疗费用为20.7万元。
歌礼获批丙肝药物
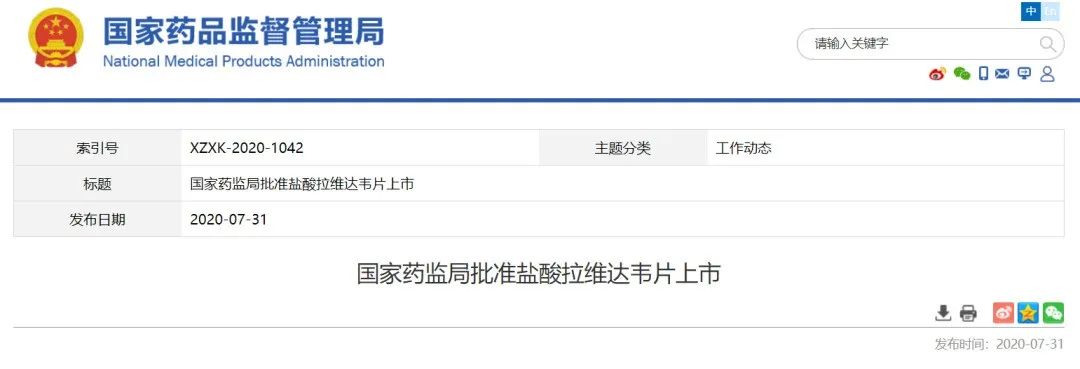
此次医保目录谈判,很遗憾歌礼1类创新药盐酸拉维达韦片(商品名:新力莱)未能中标。
7月31日,NMPA宣布批准歌礼
盐酸拉维达韦片
上市,联合达诺瑞韦钠片和利巴韦林,用于治疗初治的基因1b型慢性丙型肝炎病毒感染的非肝硬化成人患者。
歌礼作为中国本土丙肝新药军团,其支付价格也随之成为各方关注焦点。
尤其是,不少丙肝患者地处不发达地区,丙肝药的定价高低对其意义重大。
可惜的是,此次医保歌礼并未如愿进入医保目录,未
来其新力莱的商业化之路并不容易!
贝达药业获批抗癌药
打破了国内ALK阳性非小细胞肺癌靶向治疗药均是进口药的垄断局面
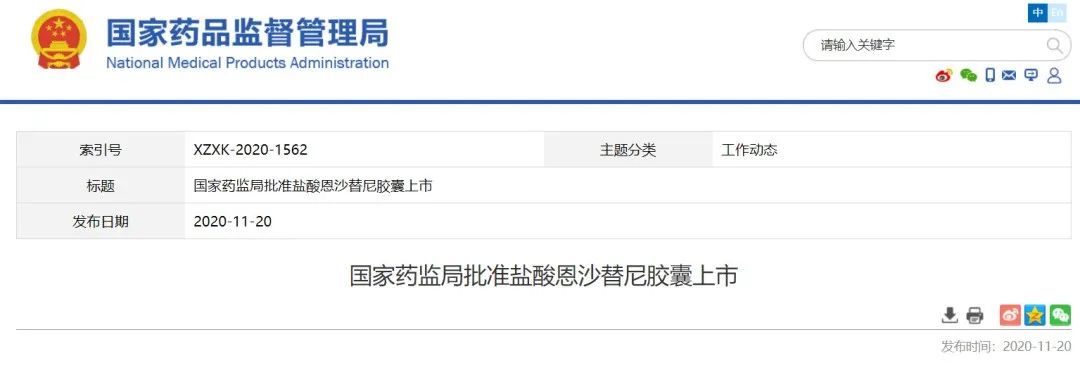
11月20日,NMPA宣布附条件批准贝达药业的1类创新药
盐酸恩沙替尼胶囊
(商品名:凯美纳)
上市,用于局部晚期或转移性非小细胞肺癌患者的治疗。
其上市打破了国内ALK阳性非小细胞肺癌靶向治疗药均是进口药的垄断局面。
截止目前,除了贝达药业的恩沙替尼,国内还有3款获批上市的ALK抑制剂,分别是
辉瑞的克唑替尼(商品名:赛可瑞),2018年10月国家抗癌药谈判进入全国医保乙类,年费用为16-19万;
诺华的赛瑞替尼,2018年10月国家抗癌药谈判进入全国医保乙类,降价后年费用为21.7万;
罗氏的阿来替尼(商品名:安圣莎),70%的降幅进入2019年国家医保乙类目录,价格从49980元一盒降至15235元一盒。
盐酸恩沙替尼胶囊(商品名:贝美纳)的终端售价为1358元/瓶(规格:25mg*7粒/瓶)和7644元/瓶(规格:100mg*14粒/瓶)。
价格相比其它三家外企优势很大,但由于贝达药业恩沙替尼获批较晚,所以无缘于今年的医保谈判。
不过,有分析人士表示,以其突出疗效以及国产创新药的价格优势,明年医保目录动态调整中,其将是医保谈判的重磅选手之一,有望通过医保实现迅速放量。
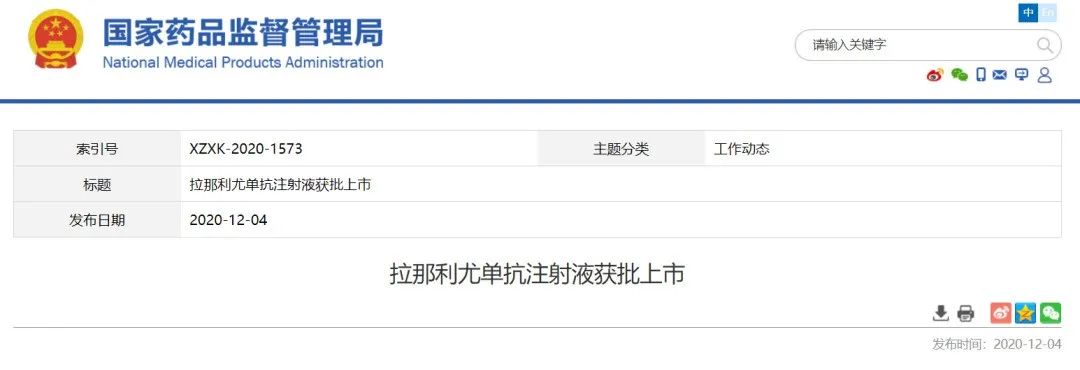
武田获批罕见病药物
全球首个用于HAE长期预防治疗的单克隆抗体
12月4日,NMPA宣布批准武田拉那利尤单抗(lanadelumab,商品名:达泽优)注射液上市,用于治疗遗传性血管水肿(HAE)的罕见遗传病。
该药物于2018年在美国获批上市,成为了
全球首个用于HAE长期预防治疗的单克隆抗体
。
该药物是武田罕见病重磅之一,其罕见病业务又分为三个细分业务,即血液学罕见病药物、代谢领域罕见病药物、以及遗传性血管性水肿药物。
自武田合并夏尔之后,将其重心放在了五大领域:
消化、罕见病、血液制品、肿瘤、神经科学
,当下增长也主要来源于对Shire的收购。
2020年武田仅在中国获批一款新药,而且直指罕见病。
可以看出武田“消化”夏尔后,开始正式进军国内罕见病市场。
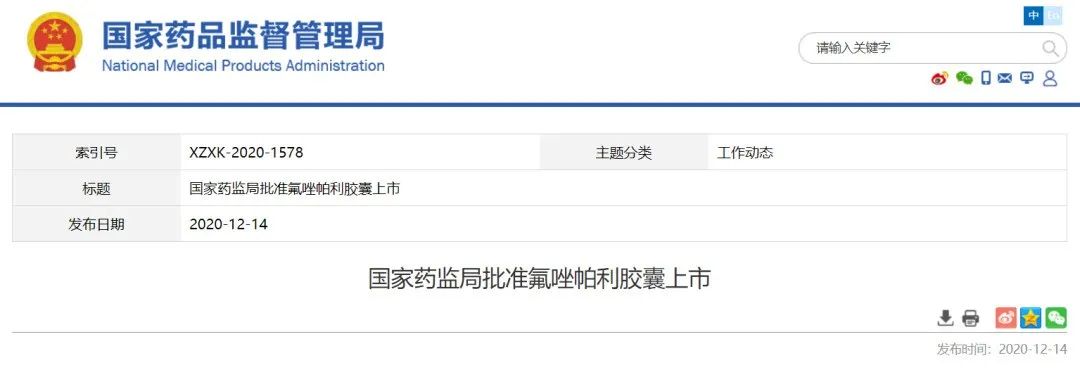
恒瑞获批抗卵巢癌药
国内企业自主研发的首个PARP抑制剂
12月14日,NMPA宣布附条件批准恒瑞医药重磅1类新药
氟唑帕利胶囊
上市。
该药是
国内企业自主研发的首个PARP抑制剂
,用于治疗既往经过二线及以上化疗的伴有 BRCA1/2 致病性或疑似致病性突变的复发性
卵巢癌
患者。
据数据显示,目前,全球共有 4 个PARP 抑制剂上市:阿斯利康的奥拉帕利、GSK的尼拉帕利、辉瑞的拉唑帕利、Clovis的芦卡帕利。
*其中阿斯利康的奥拉帕利和GSK尼拉帕利已在 2018 和 2019 分别在国内获批上市。
值得注意的是阿斯利康的奥拉帕利全球销售额连年增长,在2019年已达到16.42亿美元,同比增长94.8%,市场潜力巨大。
在中国市场,其在2019年医保谈判中降价 61.8% 进入医保乙类目录,医保支付标准为 169.00 元(150mg/片)。
恒瑞此时获批氟唑帕利胶囊无疑压力巨大,不过,恒瑞已针对氟唑帕利开展了 26 项临床。
其适应症涉及小细胞肺癌、实体瘤、复发转移三阴乳腺癌、前列腺癌、复发性卵巢癌、晚期胃癌等。其中,15项临床尚在进行中,包括4项III期临床。
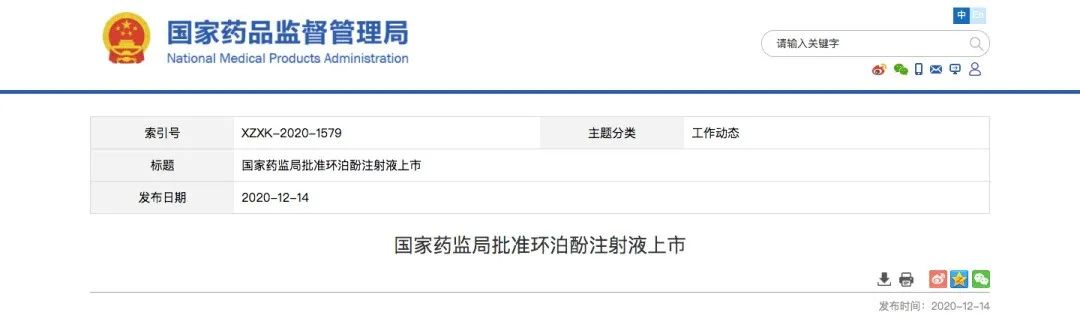
海思科医药获批麻醉药物
历时8年研发的中国首个自主化合物创新静脉麻醉药,也是海思科医药第一个获批上市的1类新药
12月14日,NMPA宣布批准海思科医药1类创新药
环泊酚注射液(商品名:思舒宁)
上市,其适应症为消化道内镜诊断和治疗镇静和/或麻醉。
这是海思科医药历时8年研发的中国首个自主化合物创新静脉麻醉药,也是海思科医药第一个获批上市的1类新药
。
目前,该药在国内登记20项 I-III 期临床研究,其中16项已完成,4 项正在进行。
开展的适应症包括无痛消化内镜诊疗的镇静和/或麻醉(已进行 NDA 申报)、全身麻醉诱导(已进行 NDA 申报)、纤维支气管镜诊疗的镇静和/或麻醉(III 期)、全身麻醉诱导和维持(III 期)、ICU 镇静(III 期)等。
该药主要市场由费森尤斯卡比占有,国内过一致性评价的只有江苏盈科生物制药和科伦药业。
海思科估计其国内市场规模有望超过 30 亿元。本次该药获批上市,预计将对丙泊酚已有市场产生一定影响。
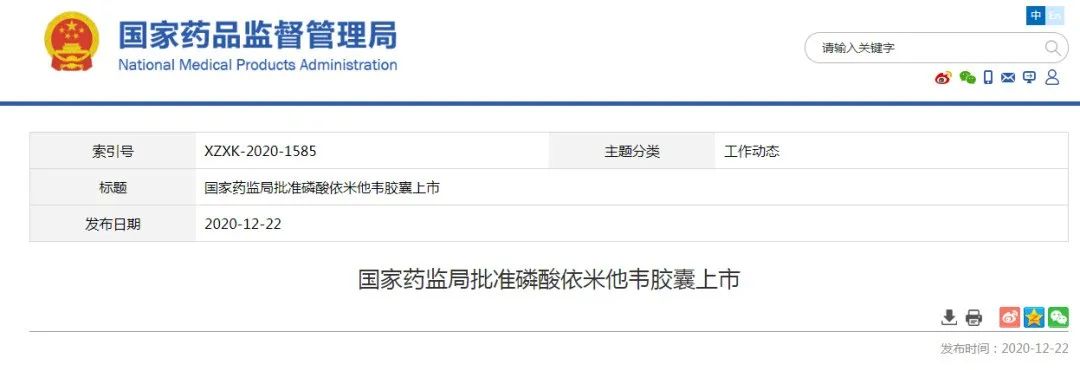
东阳光药业获批丙肝药
第一批中国本土企业自主研发成功且成功上市的DAA(丙肝病毒药物)新药之一
12月22日,NMPA宣布已批准东阳光药业的1类创新药磷酸依米他韦胶囊(商品名:东卫恩)上市,与索磷布韦(一种NS5B多聚酶核苷抑制剂)片联合用于治疗成人基因1型非肝硬化慢性丙型肝炎。
其
是
第一批中国本土企业自主研发成功且成功上市的DAA(丙肝病毒药物)新药之一
。
东阳光药是一家专注于抗病毒、内分泌及代谢性疾病、心血管疾病等治疗领域产品开发、生产及销售的中国制药企业,在中国生产、推广及销售合共33款医药产品。
诺诚健华获批治疗淋巴瘤药
今年NMPA“官宣”批准的第二款BTK抑制剂
继百济神州6月3日,获批泽布替尼胶囊,成为首款获批的中国国产BTK抑制剂。
12月25日,NMPA宣布批准诺诚健华研发的1类创新药
奥布替尼(商品名:宜诺凯)
上市,治疗淋巴瘤患者。
这是今年NMPA“官宣”
批准的第二款BTK抑制剂
。
截止目前,在全球范围内已有 4 款 BTK 抑制剂获批,即强生/艾伯维的伊布替尼、阿斯利康/Acerta Pharma 的阿卡替尼、吉利德/小野制药的 tirabrutinib 和百济神州的泽布替尼。
值得注意的是百济神州
的泽布替于6月10日获NMPA批准上市,并且进入此次医保谈判。
无论是获批时间、支付价格诺诚健华的奥布替尼似乎都不占优势!
未来或许在适应症领域,诺诚健华可以扳回一城,目前其有
8项
适应症处于开发阶段:
创新是医药经济持续增长的引擎,从全球药品销售额来看,创新药占80%,且在未来相当长的时间里,创新药的价值也将继续主导全球药品市场。
2020年,中国市场经历了代理、仿制、追赶阶段,13款新药的获批意味着“创新”崭新纪元。
而2021必将是更崭新的开始!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。










 个人中心
个人中心
 我是园区
我是园区




