您还不是认证园区!
赶快前去认证园区吧!
▎药明康德内容团队编辑

边缘区淋巴瘤(MZL)是一组缓慢生长的成熟B细胞非霍奇金淋巴瘤(NHL)。MZL通常被认为是一种慢性不治之症,在美国,MZL是第三大最常见的B细胞NHL,约占所有NHL病例的8%。滤泡性淋巴瘤(FL)是一种起源于B淋巴细胞的非霍奇金淋巴瘤(NHL),FL是最常见的惰性淋巴瘤,约占所有NHL病例的20%。
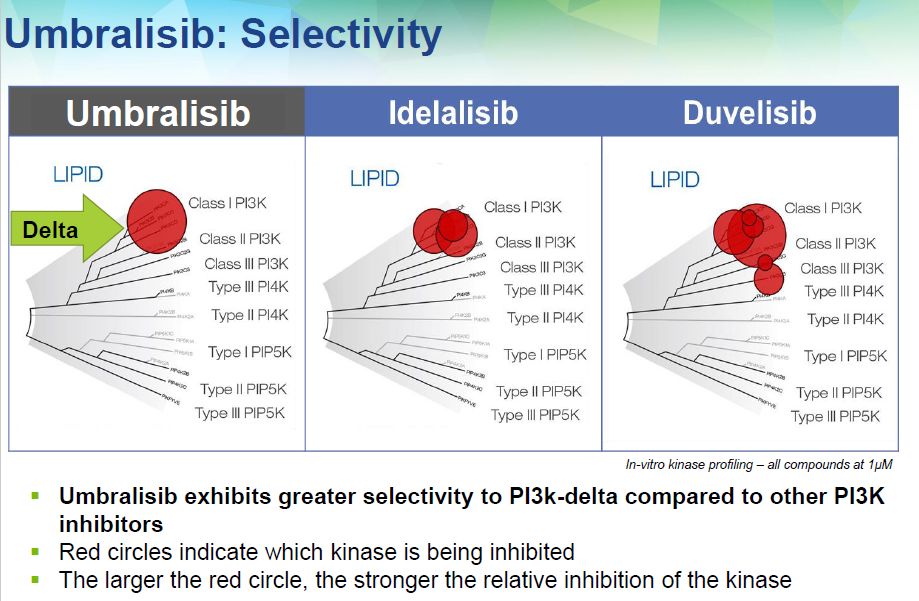
Umbralisib的NDA主要基于名为UNITY-NHL的2b期试验。该试验评估了umbralisib治疗复发/难治性MZL或FL患者的疗效和安全性。TG Therapeutics此前已宣布,每个队列均达到了总缓解率(ORR)的主要终点,ORR达到该公司指定的40%-50%的范围,这一表现得到了独立审查委员会(IRC)的证实。
TG Therapeutics执行董事长兼首席执行官Michael S.Weiss先生表示,"我们对FDA接受我们的首次NDA提交感到非常高兴,并期待在审评过程中与FDA合作。如果获得批准,我们相信umbralisib可以成为MZL和FL患者的重要治疗选择。我们预计在年底之前公布支持此次NDA递交的UNITY-NHL试验数据。”
参考资料:
[1] TG Therapeutics Announces FDA Acceptance of New Drug Application for Umbralisib as a Treatment for Patients with Previously Treated Marginal Zone Lymphoma and Follicular Lymphoma. Retrieved August 13, 2020, from http://www.globenewswire.com/news-release/2020/08/13/2077775/0/en/TG-Therapeutics-Announces-FDA-Acceptance-of-New-Drug-Application-for-Umbralisib-as-a-Treatment-for-Patients-with-Previously-Treated-Marginal-Zone-Lymphoma-and-Follicular-Lymphoma.html
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。




 个人中心
个人中心
 我是园区
我是园区




