专家点评Nat Chem | 林晨翔/顾宏周合作开发利用DNA纳米组装体按粒径大小精确分选脂质体的新策略
收藏
关键词:
DNA合作开发Nat合作新策略
资讯来源:BioArt + 订阅账号
发布时间:
2021-03-31
在细胞中,无论是胞内囊泡与细胞器还是胞外的分泌囊泡,大量膜蛋白可以在具有极高曲率的弯曲膜上
(曲率半径<50 nm)
分布并维持其结构域,为了理解这些膜蛋白与高曲率膜的依存关系及其功能行为,人们亟需一种模型体系进行膜结构的仿生研究,而粒径大小精确可控的脂质体可以提供这样的理想平台
(粒径与曲率成反比)
。在现有的脂质体制备策略中,粒径大小的调控依赖于制备条件、均一化的处理方式及纯化方式等,但得到的脂质体产物或者均一性不足,或者只具备若干离散的尺寸,无法形成一条尺度连续分布的谱系供精确分析研究。
2021年3月30日,耶鲁大学林晨翔研究组与复旦大学生物医学研究院顾宏周研究组合作在Nature Chemistry期刊上发表了文章
Sorting sub-150-nm liposomes of distinct sizes by DNA-brick-assisted centrifugation
,
报道了一种全新的脂质体分选策略。
研究者
利用DNA纳米组装体比重大、均一度好且易编辑的特性,修饰脂质体囊泡使其产生与粒径大小关联的密度差异,从而在密度梯度介质中分离获得尺寸连续分布且均一的脂质体
(图1)
,
建立了可用于精确定量研究膜蛋白作用的脂质体平台。
图1:利用DNA纳米组装体辅助脂质体按粒径大小精确分离的原理
作者示范了基于“DNA组装体辅助法”可通过一次超速离心,分离多个粒径连续分布在30-150 nm内且大小高度均一的脂质体组分;与其它常规制备方法相比,新方法不仅实现了多种尺寸脂质体的同时制备,而且将脂质体的大小区分精度从50-100 nm左右提升到10-18 nm,偏差率从35%-40%降低到9%-14%
(图2)
。
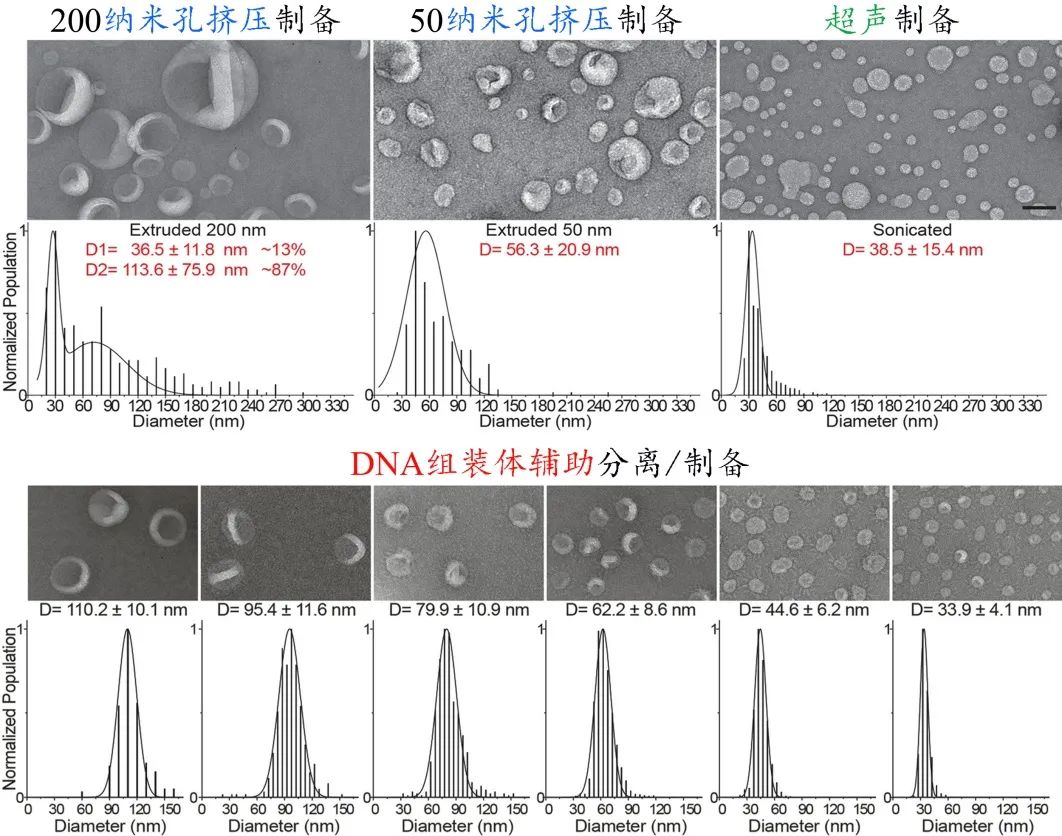 图2:不同方法制备/分离的脂质体囊泡的对比
对于DNA组装体修饰可能会影响脂质体结构的完整度,作者使用脂质体装载一类核酶
(感应锌离子发生自剪切的DNA序列)
进行了渗漏性的检验:将DNA组装体辅助分选的脂质体置于含有锌离子的溶液中孵育12h,发现脂质体内的核酶没有发生自剪切,直到加入表面活性剂将膜溶解
(图3)
。这一现象直接证明了分选后的脂质体既不会向内漏入锌离子,也不会向外漏出核酶分子,保持了很好的完整度。同时,作者还发现,经DNA结构包被的脂质体可在室温下保持形态稳定超过六个月,在需要裸露出膜表面时可利用核酸外切酶对DNA组装体修饰进行降解去除。
随后,作者基于粒径大小精确可控的一系列脂质体系统性研究了多种膜表面反应和膜蛋白作用。ATG3是一种能够感知膜曲率变化的连接酶,自噬体的生长成熟伴随着其膜表面的磷脂经ATG3催化后的脂质化
(GL1)
。利用多个粒径分布在30-130 nm的脂质体组分,作者首次确定了GL1脂质化反应更易发生在粒径为30-55 nm的脂质体上,且在40 nm时反应效率最高
(图4)
。由此可见,粒径均一且连续分布的脂质体提高了体外研究脂化反应的精度,为定量分析和测量其它依赖于囊泡粒径大小的生化作用提供了可靠的研究平台。
图2:不同方法制备/分离的脂质体囊泡的对比
对于DNA组装体修饰可能会影响脂质体结构的完整度,作者使用脂质体装载一类核酶
(感应锌离子发生自剪切的DNA序列)
进行了渗漏性的检验:将DNA组装体辅助分选的脂质体置于含有锌离子的溶液中孵育12h,发现脂质体内的核酶没有发生自剪切,直到加入表面活性剂将膜溶解
(图3)
。这一现象直接证明了分选后的脂质体既不会向内漏入锌离子,也不会向外漏出核酶分子,保持了很好的完整度。同时,作者还发现,经DNA结构包被的脂质体可在室温下保持形态稳定超过六个月,在需要裸露出膜表面时可利用核酸外切酶对DNA组装体修饰进行降解去除。
随后,作者基于粒径大小精确可控的一系列脂质体系统性研究了多种膜表面反应和膜蛋白作用。ATG3是一种能够感知膜曲率变化的连接酶,自噬体的生长成熟伴随着其膜表面的磷脂经ATG3催化后的脂质化
(GL1)
。利用多个粒径分布在30-130 nm的脂质体组分,作者首次确定了GL1脂质化反应更易发生在粒径为30-55 nm的脂质体上,且在40 nm时反应效率最高
(图4)
。由此可见,粒径均一且连续分布的脂质体提高了体外研究脂化反应的精度,为定量分析和测量其它依赖于囊泡粒径大小的生化作用提供了可靠的研究平台。
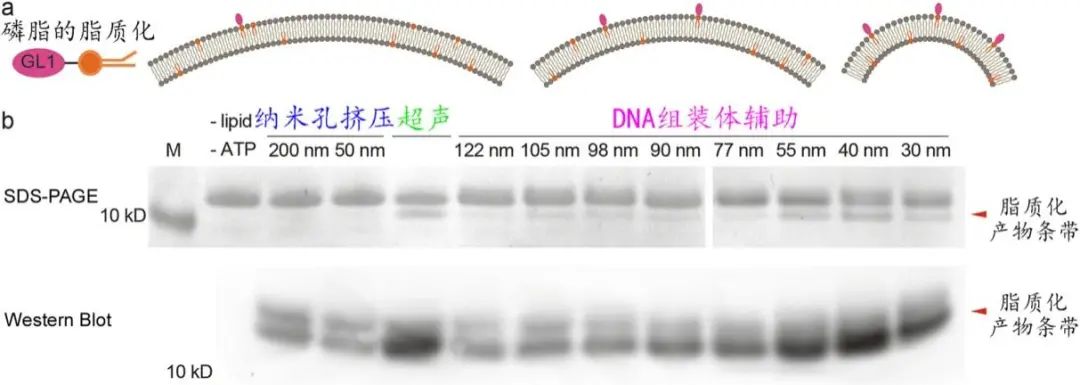 图4:精细化研究曲率敏感的蛋白脂化反应
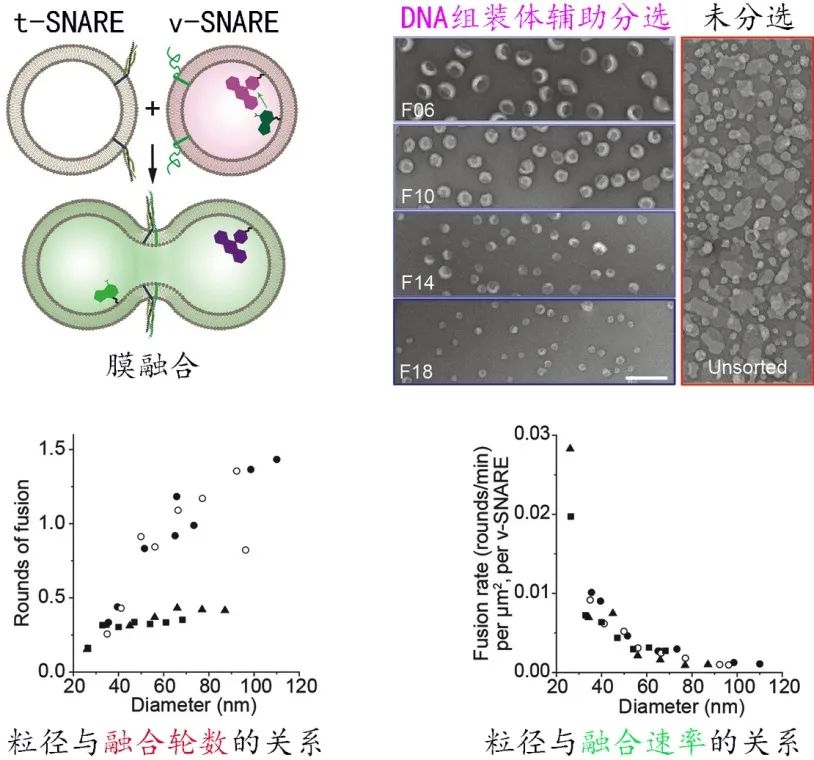
作为调控细胞膜融合的一类关键蛋白,v-SNAREs和t-SNAREs通过特异互作拉近膜之间的相互距离。此前的研究表明,膜曲率可能是决定这一融合过程发生的关键性因素,但因缺乏尺度连续分布的脂质体模型,曲率依赖性膜融合的系统性研究始终无法很好的开展。作者证明DNA纳米组装体同样可辅助Proteoliposome
(镶嵌了跨膜蛋白的脂质体)
按粒径大小进行精确分离
(图5)
。在30-110 nm范围内,依托分离出的一系列大小均一并携带了v-SNARE的脂质体,作者得以精确地测量膜曲率对膜融合的影响,揭示了膜曲率越高则融合速率越快,且粒径小于60 nm的脂质体的融合速率和融合轮次显著升高的规律。该工作为更好地模拟细胞生成的囊泡和系统分析测量曲率相关的“膜-膜互作”提供了模板。
值得一提的是,差不多同一时间内,顾宏周研究组于Chem期刊发表
DNA-catalyzed efficient production of single-stranded DNA nanostructures
的文章
(详见BioArt今日的单独推送)
,开发了一套生物合成制备DNA纳米组装体的方法,解决了DNA作为一种消耗品在DNA纳米组装体辅助分选脂质体时的材料来源和成本问题,为大量生产和制备高品质的脂质体扫清了障碍。该脂质体制备方法的成熟有望为膜生物学和脂质体药物递送的研究提供强大的助力。
据悉,耶鲁大学医学院林晨翔教授和复旦大学生物医学研究院顾宏周教授为本文的共同通讯作者。杨洋
(耶鲁大学/上海交通大学)
、吴振永
(耶鲁大学)
为本文共同第一作者,夏凯
(复旦大学/附属中山医院)
为本文的数据重复等提供了重要的支持。
另外,本文的第一作者 杨洋,现为上海交通大学医学院教授。杨洋、顾宏周两个课题组目前均在招聘博士后。
1、https://www.nature.com/articles/s41557-021-00667-5
图4:精细化研究曲率敏感的蛋白脂化反应
作为调控细胞膜融合的一类关键蛋白,v-SNAREs和t-SNAREs通过特异互作拉近膜之间的相互距离。此前的研究表明,膜曲率可能是决定这一融合过程发生的关键性因素,但因缺乏尺度连续分布的脂质体模型,曲率依赖性膜融合的系统性研究始终无法很好的开展。作者证明DNA纳米组装体同样可辅助Proteoliposome
(镶嵌了跨膜蛋白的脂质体)
按粒径大小进行精确分离
(图5)
。在30-110 nm范围内,依托分离出的一系列大小均一并携带了v-SNARE的脂质体,作者得以精确地测量膜曲率对膜融合的影响,揭示了膜曲率越高则融合速率越快,且粒径小于60 nm的脂质体的融合速率和融合轮次显著升高的规律。该工作为更好地模拟细胞生成的囊泡和系统分析测量曲率相关的“膜-膜互作”提供了模板。
值得一提的是,差不多同一时间内,顾宏周研究组于Chem期刊发表
DNA-catalyzed efficient production of single-stranded DNA nanostructures
的文章
(详见BioArt今日的单独推送)
,开发了一套生物合成制备DNA纳米组装体的方法,解决了DNA作为一种消耗品在DNA纳米组装体辅助分选脂质体时的材料来源和成本问题,为大量生产和制备高品质的脂质体扫清了障碍。该脂质体制备方法的成熟有望为膜生物学和脂质体药物递送的研究提供强大的助力。
据悉,耶鲁大学医学院林晨翔教授和复旦大学生物医学研究院顾宏周教授为本文的共同通讯作者。杨洋
(耶鲁大学/上海交通大学)
、吴振永
(耶鲁大学)
为本文共同第一作者,夏凯
(复旦大学/附属中山医院)
为本文的数据重复等提供了重要的支持。
另外,本文的第一作者 杨洋,现为上海交通大学医学院教授。杨洋、顾宏周两个课题组目前均在招聘博士后。
1、https://www.nature.com/articles/s41557-021-00667-5
2、https://www.cell.com/chem/fulltext/S2451-9294(20)30633-1
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
磷脂囊泡作为科研界的宠儿,在生物物理、生理生化、细胞代谢、神经信号传导、载药给药等诸多领域,几十年来持续受到关注和挖掘。近些年,随着外泌体研究
【1】
和新型载药体系开发
【2】
等方向的快速深入发展,纳米尺度磷脂囊泡的重要性更为凸显。然而,在天然外泌体研究中,组分复杂性始终是其系统分类与功能定位的痛点;对于人工脂质体,精准调控其形貌尺寸、内部包载与外部修饰也仍存在巨大的改进空间。因此,简洁可控的纳米级磷脂囊泡的合成制备将为上述多学科研究提供最为理想的平台。
DNA Nanotechnology作为一门可精确合成纳米结构的前沿技术,经历了三十多年的不断发展成熟,逐渐在各个领域实现了广泛的应用。尤其是利用DNA纳米结构作为框架模板指导其他材料的组装
【3】
,从而催生具有新性状和新功能的材料已经成为探索纳米材料世界的有效手段之一。相比于分子间彼此孤立的碳纳米材料、金属纳米颗粒、半导体纳米材料以及蛋白质类分子,磷脂分子由于其双亲性在纳米尺度可控组装方面遇到了更大的困难与挑战。针对这一热点和难点,美国耶鲁大学的林晨翔课题组做出了一系列开创性工作,2016年杨洋等人开发了环状框架核酸诱导组装具有精确粒径大小脂质体的通用体系
【4】
,2017年张钊等人进一步发展了管状、环状、螺旋状等形貌可控的磷脂膜组装形式
【5】
。利用这些大小、距离、修饰数量与位置可控的框架核酸-脂质体复合结构,一些膜蛋白功能的精确量化研究成为可能
【6,7】
。虽然上述研究在小剂量体系或单分子研究层面提供了研究磷脂膜的全新工具,但其离散性的尺寸控制和相对较高的成本一定程度上阻碍了该技术的规模化应用。
2021年3月30日,耶鲁大学医学院纳米生物学研究所的林晨翔团队与复旦大学生物医学研究院顾宏周团队合作在Nature Chemistry杂志上在线发表了题为:Sorting sub-150-nm liposomes of distinct sizes by DNA-brick-assisted centrifugation的文章
(杨洋博士,现上海交通大学医学院研究员,与吴振永博士为本文共同第一作者)
。该研究打破了直接合成单一尺寸脂质体的传统思维,开发了一种利用DNA纳米结构作为负载,通过包覆脂质体以调节其密度并进行密度梯度离心的方式,实现了依据脂质体的粒径大小进行精确高效的分选策略。该方法适用于广泛的磷脂组成和不同粗加工来源的脂质体
(如挤出法、超声法或透析法)
,分选产物可以保持脂质体的完整性,并能提高脂质体储存的稳定性
(室温保存超过6个月)
。分选后的脂质体囊泡具有良好的单分散性,其精确量化的粒径大小为曲率依赖的膜表面理化反应提供了绝佳的研究平台。文中以自噬体相关蛋白家族的脂化反应和SNAREs蛋白家族介导的膜融合反应为例,分别测量并分析了上述两类反应效率与磷脂膜曲率之间的关系,为深入探究细胞的转运机制等奠定了基础。
同时期内,顾宏周团队又在Chem杂志上在线发表了题为:DNA-catalyzed efficient production of single-stranded DNA nanostructures的文章
【8】
,提供了一种高效合成大量单链DNA纳米结构的生物方法,为利用DNA纳米结构大规模辅助制备尺寸连续分布,且粒径高度均一的脂质体扫清了原材料的障碍。
Nature Chemistry文章中借助DNA纳米结构的密度特性分选脂质体的策略是否可移植应用于细胞外囊泡如外泌体等的分选是下一步值得探讨的话题。可以预见,由林晨翔团队与顾宏周团队合作开发的精确分选策略必将为膜相关的理化研究和围绕脂质体的纳米药物递送研究等提供新的工具和契机。
1. Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science 2020, 367(6478).
2. Akhtar N, Mohammed SA, Singh V, Abdellatif AA, Mohammad HA, Ahad A, Yusuf M, Khadri H, Naz M, Khan O, Rashid M, Khan RA. Liposome-based drug delivery of various anticancer agents of synthetic and natural product origin: a patent overview. Pharm Pat Anal 2020, 9(3): 87-116.
3. Yang Y, Zhang R, Fan C. Shaping Functional Materials with DNA Frameworks. Trends in Chemistry 2020, 2(2): 137-147.
4. Yang Y, Wang J, Shigematsu H, Xu WM, Shih WM, Rothman JE, Lin CX. Self-assembly of size-controlled liposomes on DNA nanotemplates. Nat Chem 2016, 8(5): 476-483.
5. Zhang Z, Yang Y, Pincet F, Llaguno MC, Lin CX. Placing and shaping liposomes with reconfigurable DNA nanocages. Nat Chem 2017, 9(7): 653-659.
6. Xu WM, Nathwani B, Lin CX, Wan J, Karatekin E, Pincet F, Shih W, Rothman JE. A Programmable DNA Origami Platform to Organize SNAREs for Membrane Fusion. J Am Chem Soc 2016, 138(13): 4439-4447.
7. Bian X, Zhang Z, Xiong Q, De Camilli P, Lin C. A programmable DNA-origami platform for studying lipid transfer between bilayers. Nat Chem Biol 2019, 15(8): 830-837.
8. Jia Y, Chen L, Liu J, Li W, Gu H. DNA-catalyzed efficient production of single-stranded DNA nanostructures
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。


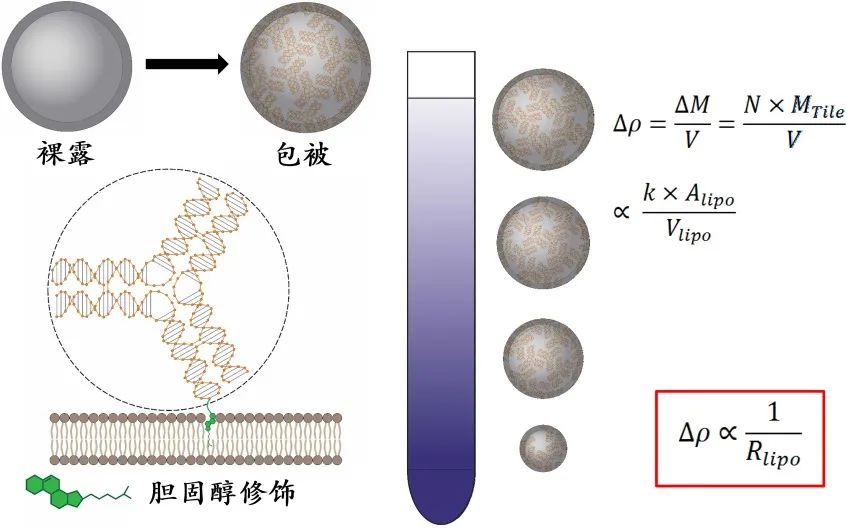
 图2:不同方法制备/分离的脂质体囊泡的对比
图2:不同方法制备/分离的脂质体囊泡的对比
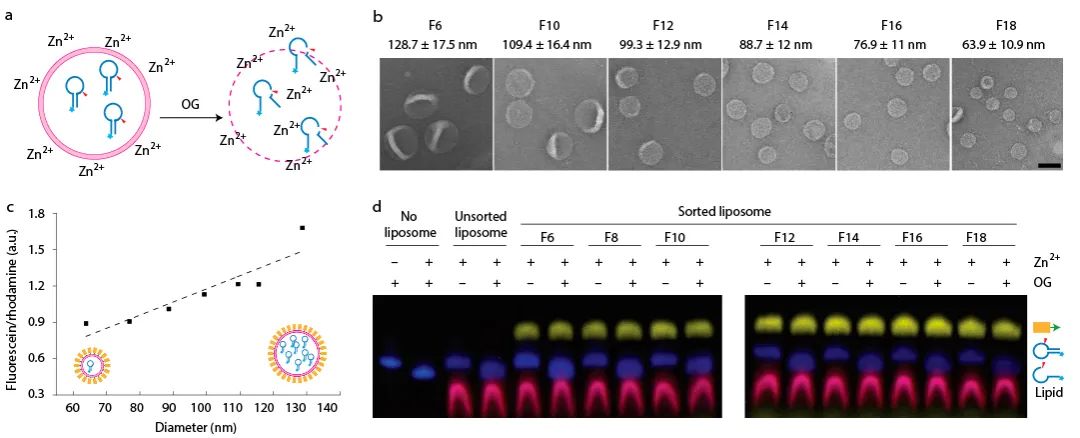
 图4:精细化研究曲率敏感的蛋白脂化反应
图4:精细化研究曲率敏感的蛋白脂化反应




 药选址
药选址


 图2:不同方法制备/分离的脂质体囊泡的对比
图2:不同方法制备/分离的脂质体囊泡的对比

 图4:精细化研究曲率敏感的蛋白脂化反应
图4:精细化研究曲率敏感的蛋白脂化反应




