Nat Comm | 黄浩杰团队揭示前列腺癌耐药新机制
收藏
关键词:
新机制揭示Nat癌药
资讯来源:BioArt + 订阅账号
发布时间:
2021-03-27
前列腺癌是男性最常见的恶性肿瘤之一。雄激素
(Androgen)
-雄激素受体
(AR)
信号轴是驱动雄激素受体阳性前列腺癌进展的主要动力。雄激素受体通过结合雄激素反应元件
(androgen response element,
ARE
)
促进或者抑制下游基因转录活性,从而导致前列腺癌细胞的增殖和转移。雄激素受体信号通路在前列腺癌的发生发展中扮演十分重要的角色,因此
去势治疗
(Androgen deprivation therapy,
ADT
)
成为目前治疗前列腺癌的主要手段。然而在ADT治疗过程中往往出现治疗抵抗和肿瘤进展,此时期的肿瘤称之为去势抵抗性前列腺癌
(Castration-resistant prostate cancer,
CRPC
)
。临床数据表明CRPC对第二代雄激素受体信号通路抑制剂如恩杂鲁胺
(Enzalutamide,ENZ)
和阿比特龙
(Abiraterone,ABI)
有显著的治疗效果,说明AR信号通路的激活在CRPC进展中仍然起重要作用。然而, CRPC对第二代雄激素受体抑制剂
(例如ENZ)
的治疗效果有限,大多数病人很快出现耐药。因此,探究CRPC对恩杂鲁胺的耐药机制、寻找治疗新靶点和新策略是当今的研究热点。
美国梅奥诊所
(Mayo Clinic)
黄浩杰教授团队与生物信息学王利国教授团队和加拿大温哥华前列腺肿瘤中心的王玉琢教授团队与中心主任Martin Gleave教授团队进行合作,最新研究成果
A noncanonical AR addiction drives enzalutamide resistance in prostate cancer
于近日在Nature Communications发表。通过ChIP-seq、RNA-seq、PDX
(patient-derived xenografts)
,患者标本免疫组化和BET/p300蛋白双重抑制剂等技术手段,
揭示了恩杂鲁胺耐药新机制并提出了新的治疗策略。
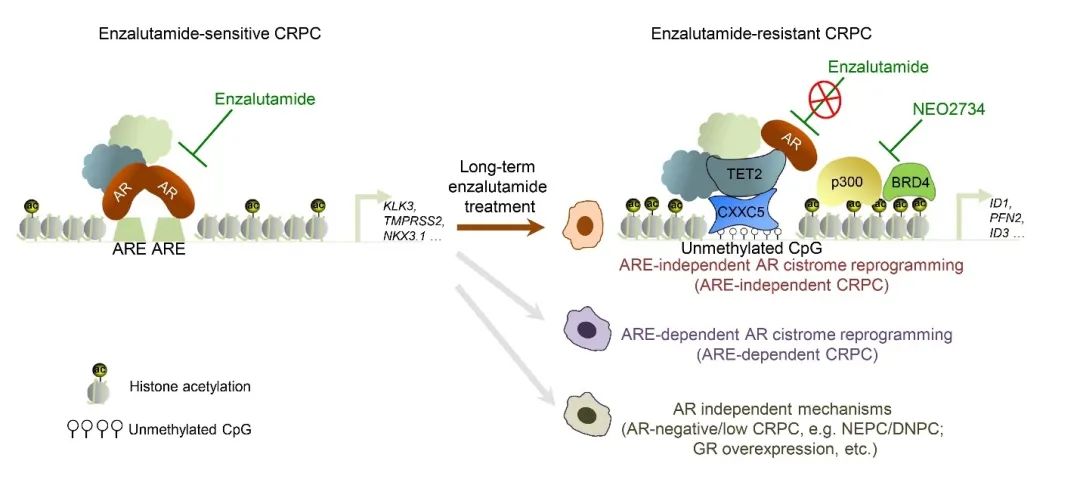
研究者通过AR ChIP-seq发现,在ENZ耐药的CRPC细胞中,并不是所有AR蛋白在染色质DNA上的结合是降低的,部分AR在染色质DNA的结合反而增加了——即AR结合增强位点
(Gained AR binding sites, gained-ARBS)
。研究人员进一步发现,在这些Gained-ARBS位点中不仅没有典型的AR结合元件ARE,也没有AR常规激活所依赖的先锋因子FOXA1的DNA结合模序
(DNA binding motif)
;相反,这些Gained-ARBS位点富集了CpG岛
(CpG islands)
,而且组蛋白基因激活型修饰H3K27乙酰化
(H3K27ac)
显著上升。这些结果提示,在ENZ耐药的CRPC细胞中,有相当一部分AR结合的基因位点是通过非常规的途径激活的。
研究者通过RNA-seq发现,在耐药细胞中CpG二核苷酸结合蛋白CXXC5显著上调,并且上调的CXXC5通过TET2介导与AR结合在基因组DNA中的非甲基化的CpG岛
(CpG islands)
上促进基因表达。进一步研究发现,在耐药细胞中结合在非甲基化CpG岛的AR转录上调ID1等一系列促肿瘤基因表达;这些下游基因的高表达不仅与CRPC病人死亡率成正相关,并能促进细胞增殖和恩杂鲁胺耐药。由于在这些AR非典型激活的基因位点中组蛋白乙酰化修饰H3K27ac显著上调,研究人员进一步证明,如恩杂鲁胺抗性前列腺癌类器官
(Organoid)
和患者来源的异体移植瘤
(PDX)
对他们先前发现的识别H3K27ac乙酰化修饰的转录调控因子BET和CBP/p300蛋白的双重抑制剂NEO2734高度敏感。
这一研究发现不仅首次揭示了CRPC细胞通过非典型AR激活功能取得恩杂鲁胺获得性耐药的新机制,同时对这种耐药的CRPC提供了新的治疗策略。
恩杂鲁胺(Enzalutamide, ENZ)耐药机制图
https://doi.org/10.1038/s41467-021-21860-7
1.
Yan Y, Ma J, Wang D, Lin D, Pang X, Wang S, Zhao Y, Shi L, Xue H, Pan Y, Zhang J, Wahlestedt C, Giles FJ, Chen Y, Gleave ME, Collins CC, Ye D, Wang Y, Huang H. The novel BET-CBP/p300 dual inhibitor NEO2734 is active in SPOP mutant and wild-type prostate cancer. EMBO Mol Med. 2019 Nov 7; 11 (11):e10659 Epub 2019 Sept 26
2. Wu D, Yan Y, Wei T, Ye Z, Xiao Y, Pan Y, Orme JJ, Wang D, Wang L, Ren S, Huang H. An acetyl-histone vulnerability in PI3K/AKT inhibition-resistant cancers is targetable by both BET and HDAC inhibitors. Cell Rep. 2021 Feb 16; 34 (7):108744
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。



 药选址
药选址


