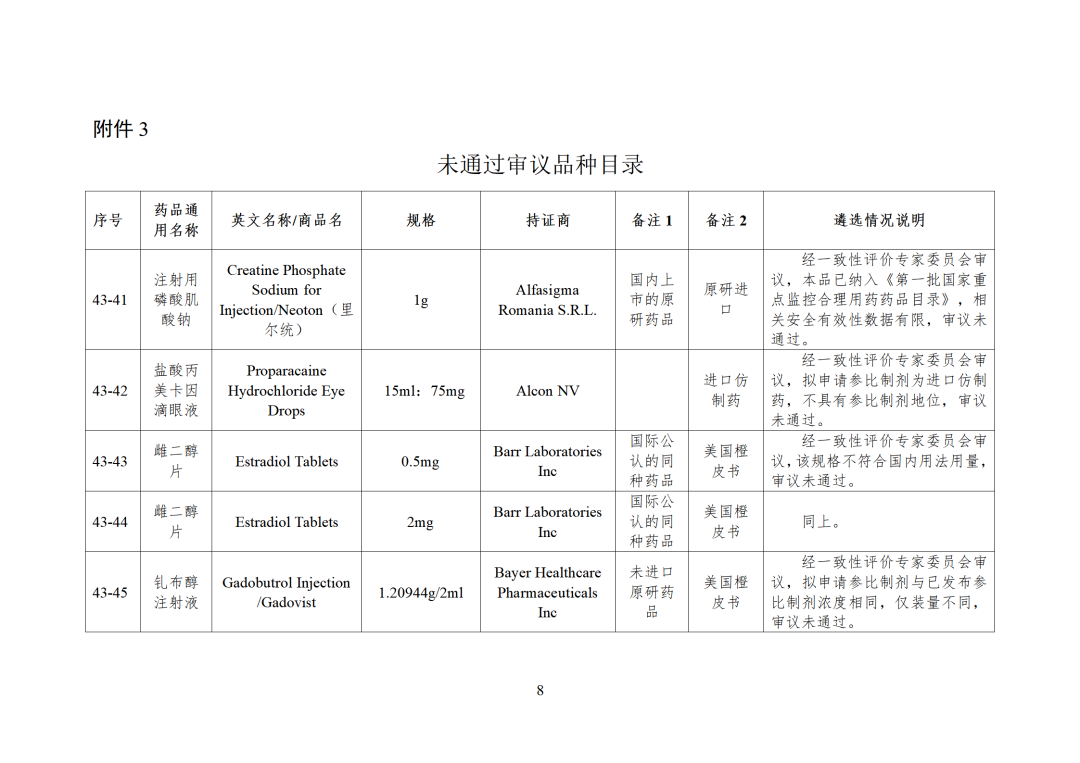
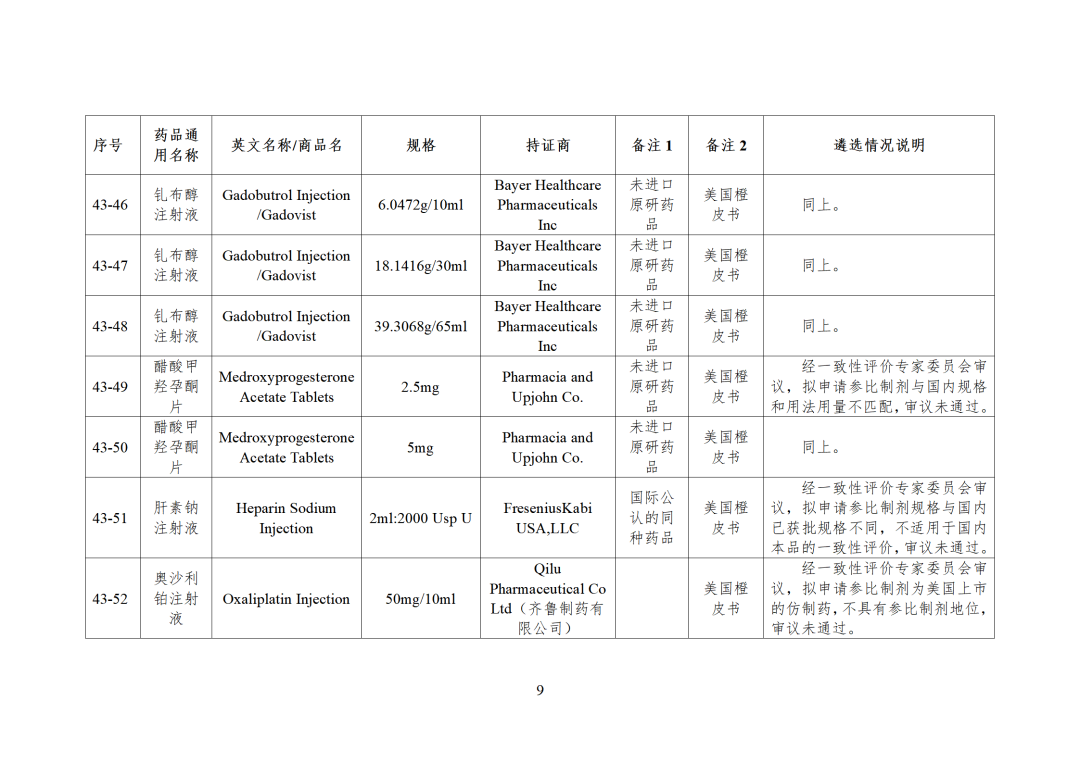
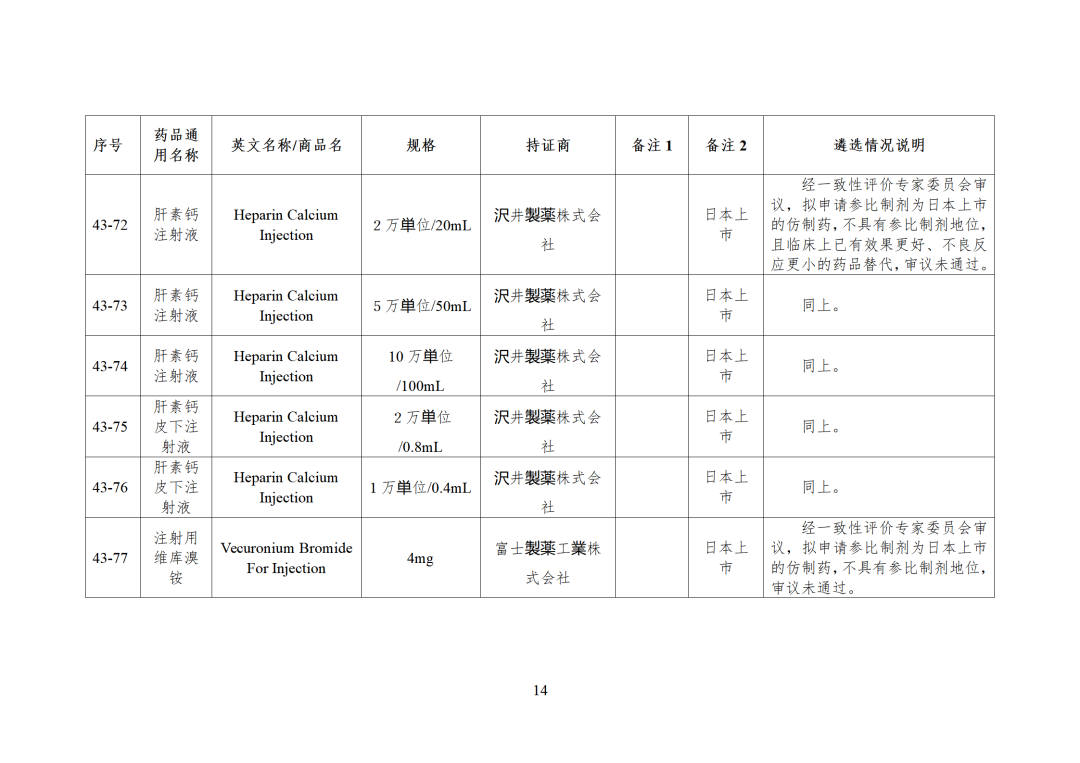
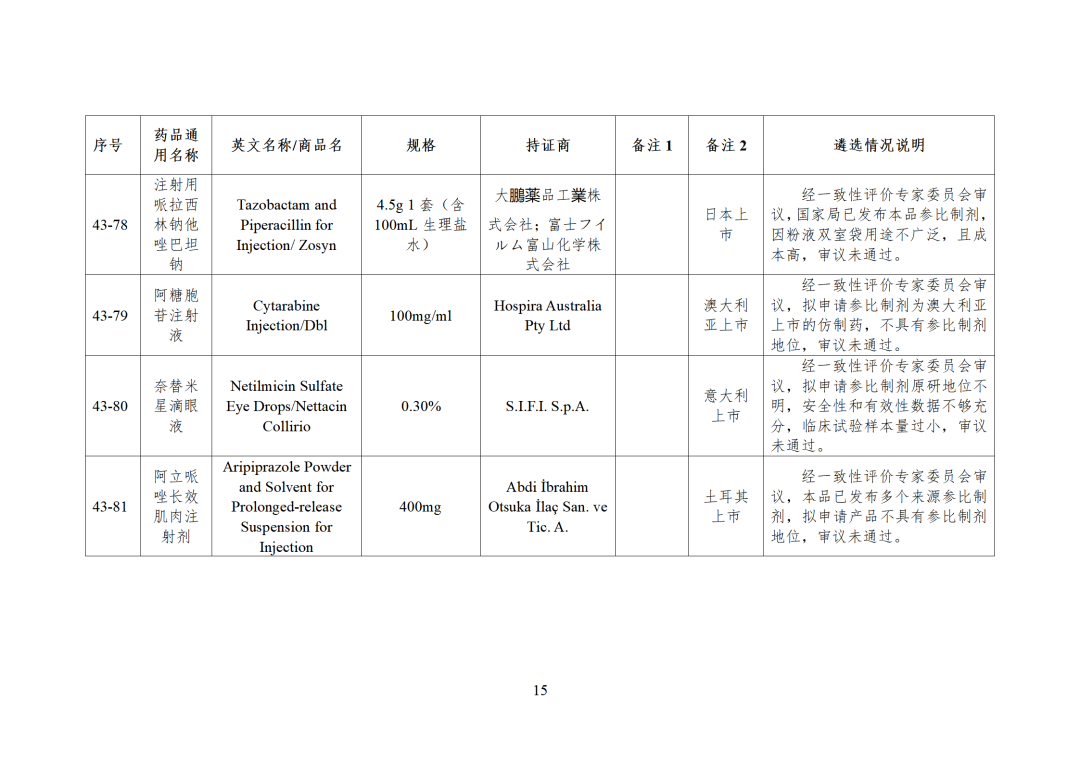
43批参比制剂公示,其中,44个参比审议未通过,目前累计164个参比制剂未通过审议!
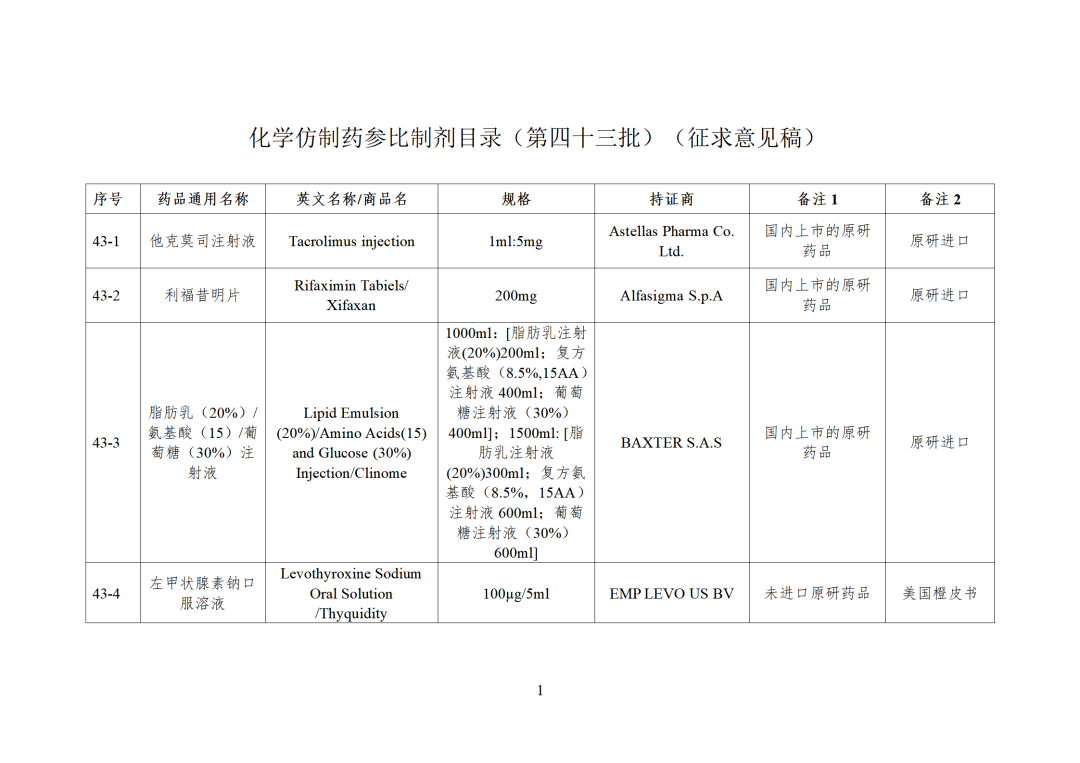
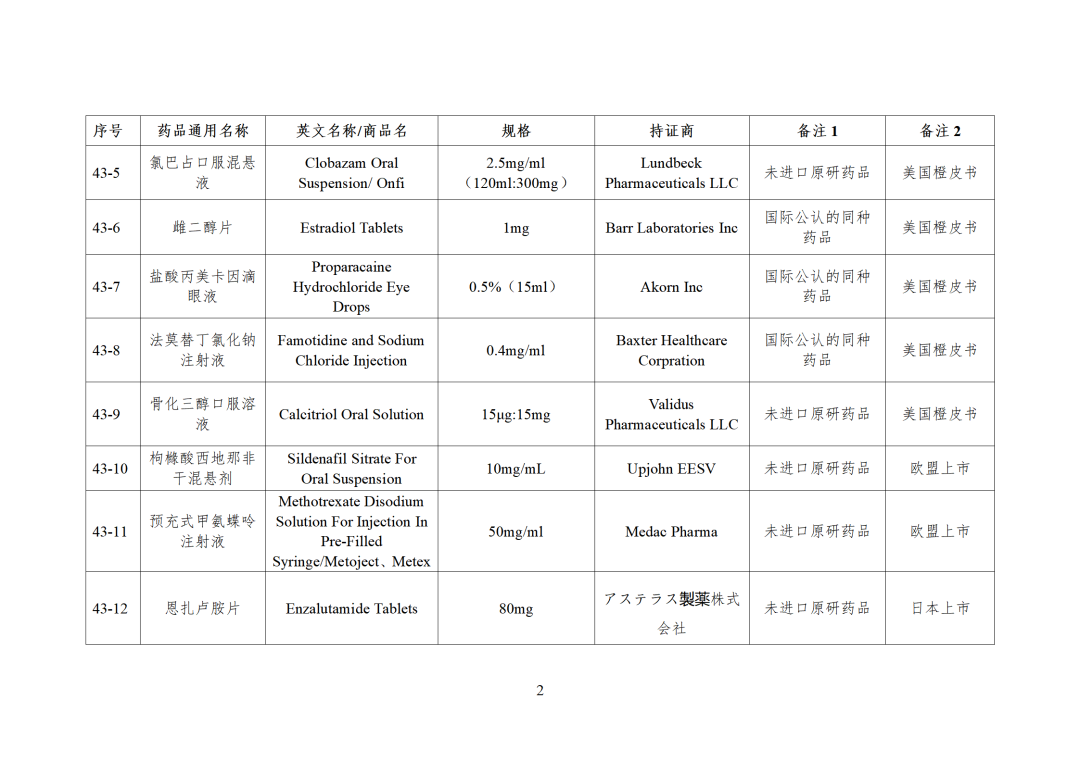
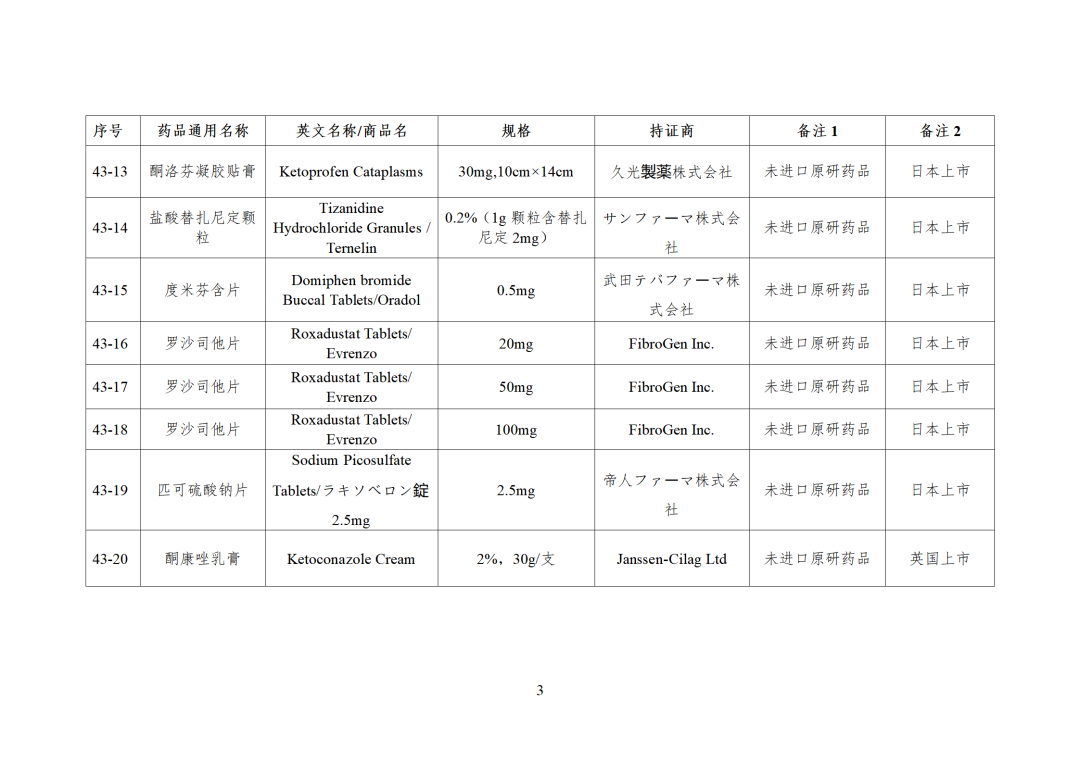
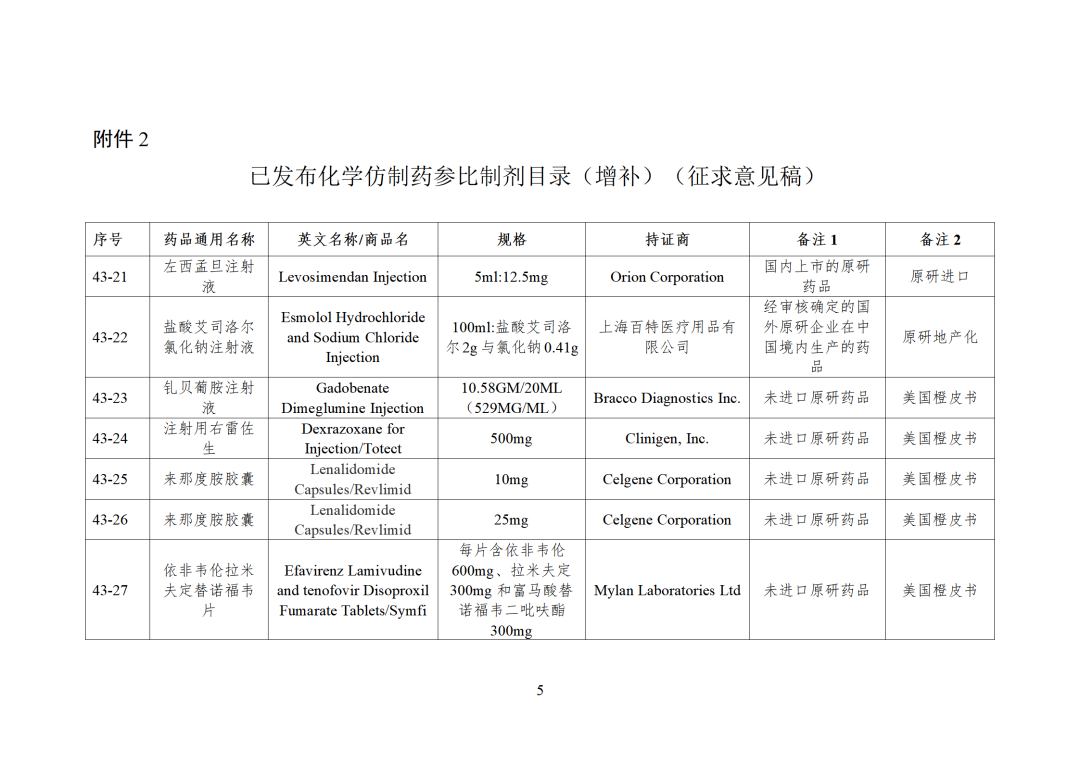
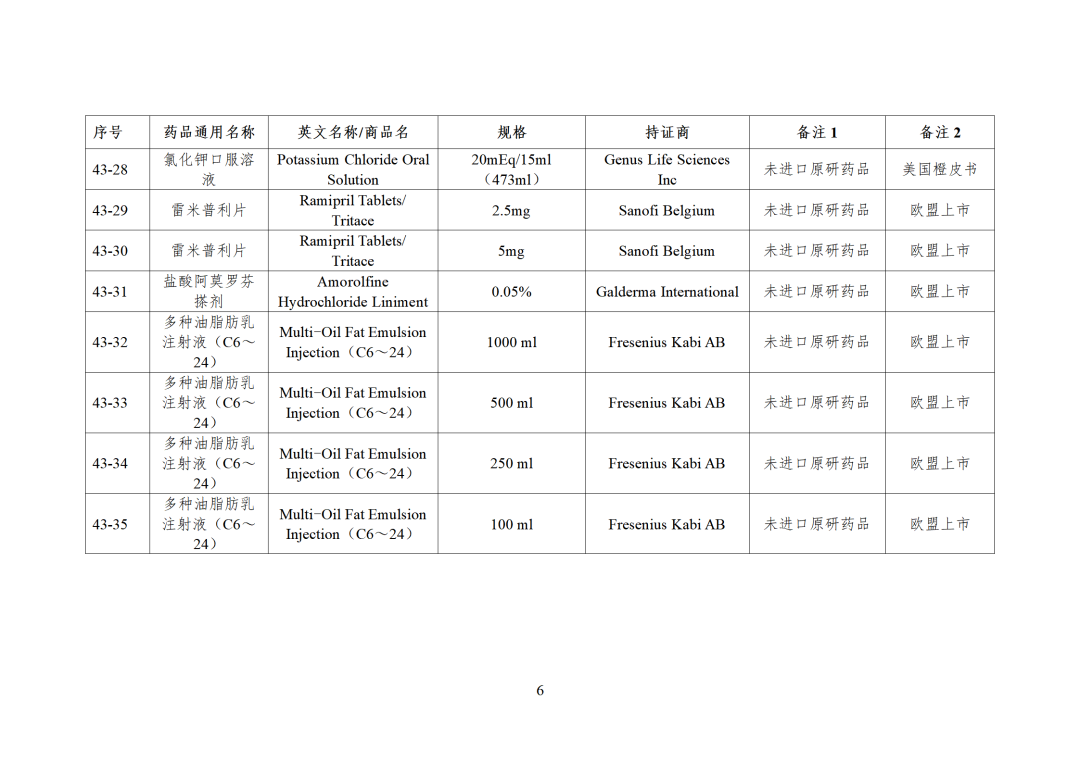
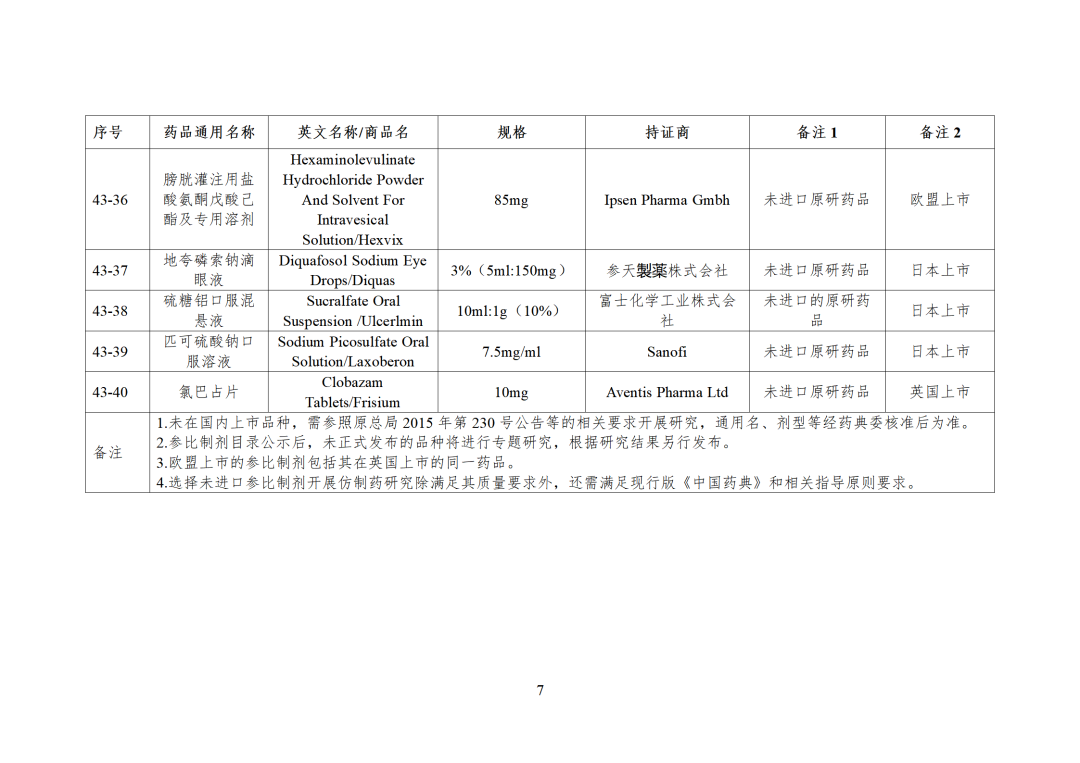
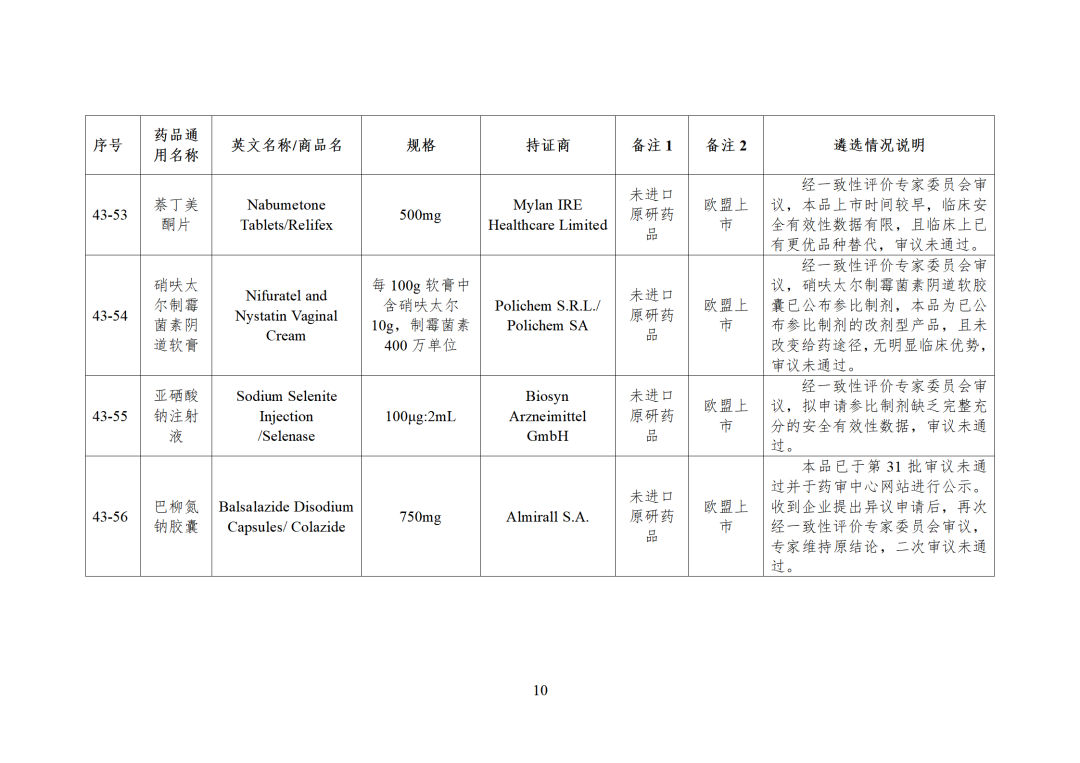
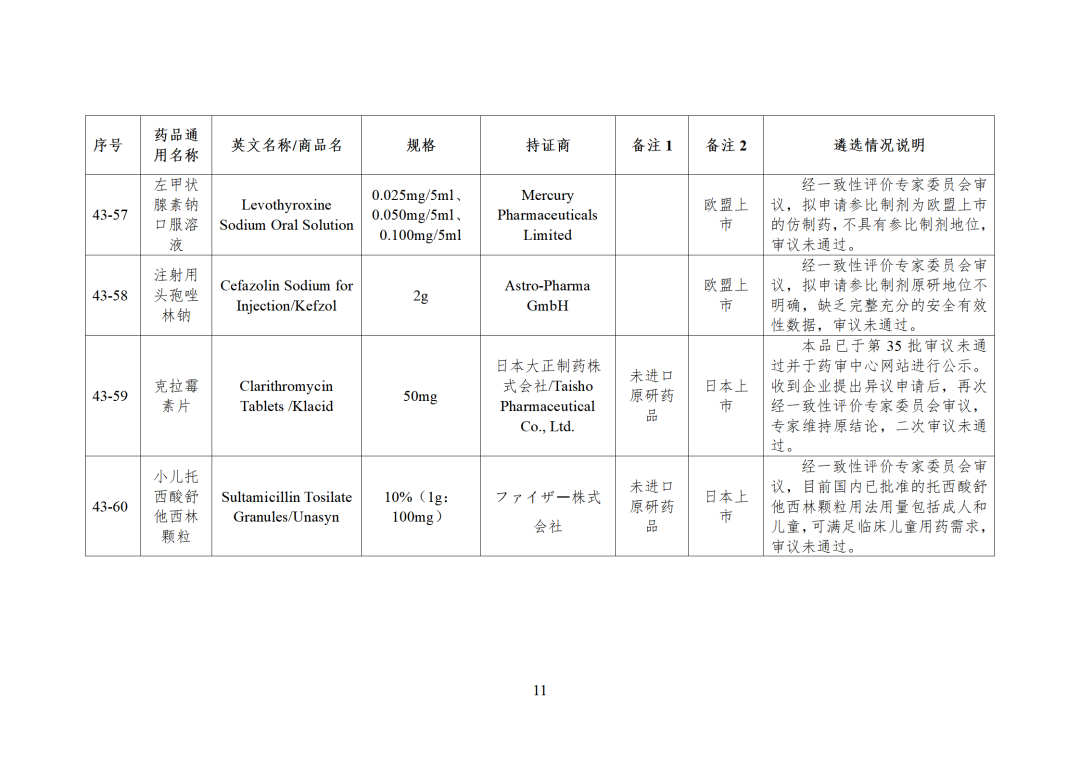
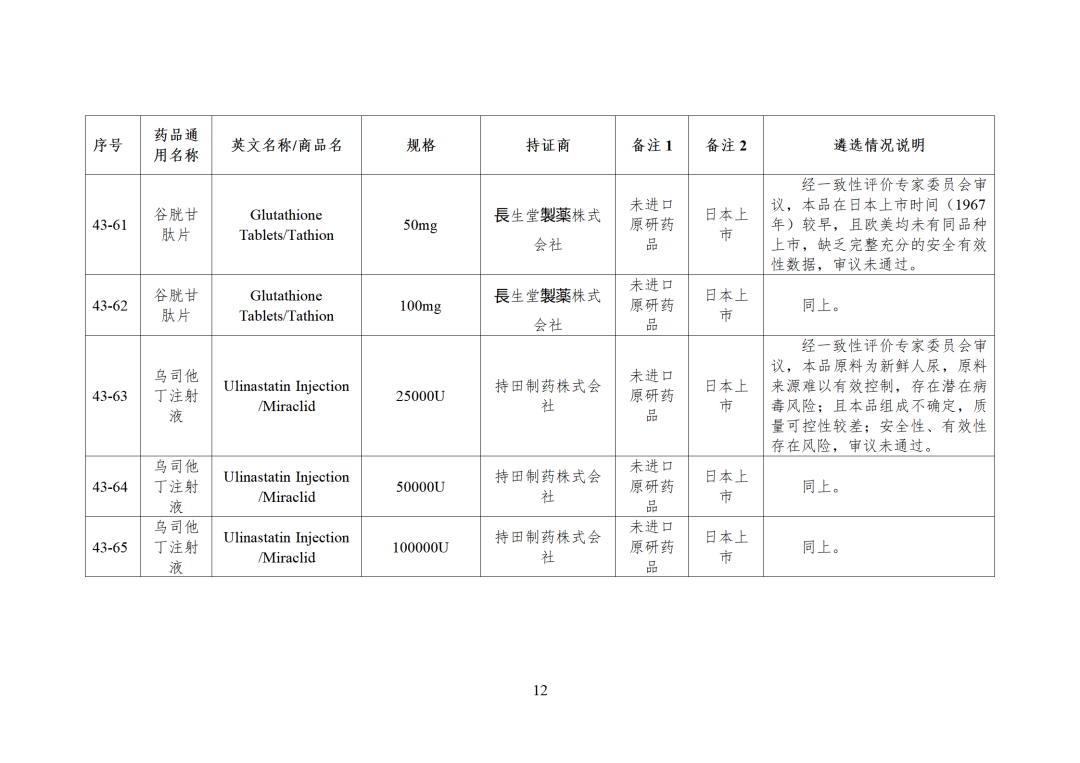
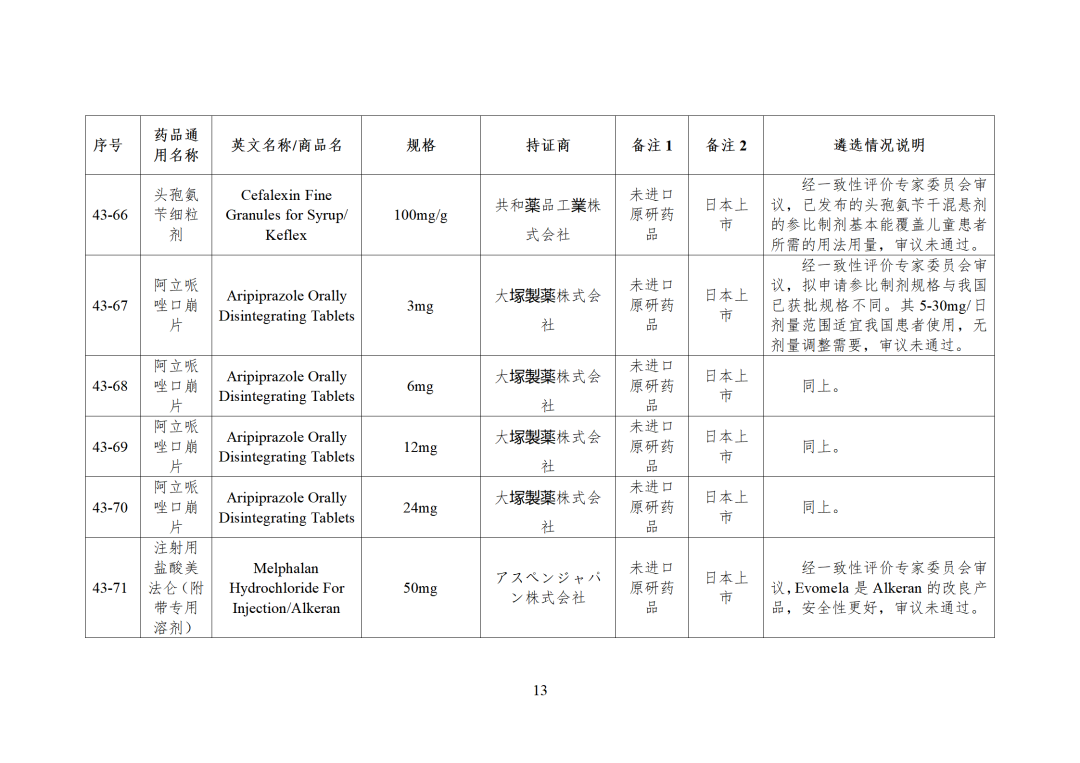
CDE发布化学仿制药参比制剂目录(第四十三批)(征求意见稿),其中20个目录,20个增补,另外有43个审议未通过,原因包括:本品上市时间较早,临床安全有效性数据有限,且临床上已有更优品种替代;为已公布参比制剂的改剂型产品,且未改变给药途径,无明显临床优势等。
此前CDE发布:
2021年04月15日,第42批参比制剂征求意见稿,8个未通过审议
2021年03月12日,第41批参比制剂征求意见稿,13个未通过审议
2021年02月03日,第40批参比制剂征求意见稿,9个未通过审议
2021年01月25日,第39批参比制剂征求意见稿,2个未通过审议
2021年01月05日,第38批参比制剂征求意见稿,9个未通过审议
2020年12月21日,第37批参比制剂征求意见稿,1个未通过审议
2020年12月21日,第36批参比制剂征求意见稿,1个未通过审议
2020年11月18日,第35批参比制剂征求意见稿,9个未通过审议
2020年09月07日,第34批参比制剂征求意见稿,1个未通过审议
2020年09月07日,第33批参比制剂征求意见稿,5个未通过审议
2020年08月05日,第32批参比制剂征求意见稿,8个审议未通过
2020年07月30日,第31批参比制剂征求意见稿,20个审议未通过
2020年06月30日,第30批参比制剂征求意见稿,9个审议未通过
2020年05月19日,第29批参比制剂征求意见稿,4个审议未通过
2020年01月10日,第26批参比制剂征求意见稿,22个审议未通过
2020年01月10日,第26批参比制剂征求意见稿,7个审议未通过
未通过审议主要原因:
-
规格不合理,小于说明书推荐单次使用最小剂量 -
该品种已发布原研进口产品作为参比制剂,且企业申请的参比制剂与已发布的参比制剂浓度一致 -
本品与国内上市品种装量不同,与国内已批准用法用量存在差异,给药受限 -
本品无参比制剂地位 -
未提供完整和充分的安全性、有效性数据 -
有关物质存在一定缺陷 -
引发疾病或者临床不良反应 -
有更安全的药品作为参比制剂等 -
已发布参比制剂为上市的处方药,不建议增加OTC药物作为参比制剂 -
与已上市其他口服制剂比较无临床应用优势 -
剂量、给药途径等存在安全性风险等 -
该规格含防腐剂,存在安全性问题 -
采用除菌过滤工艺,国内上市品种可耐受终端灭菌 -
本品上市时间较早,临床安全有效性数据有限,且临床上已有更优品种替代 -
为已公布参比制剂的改剂型产品,且未改变给药途径,无明显临床优势 -
其他详见每次参比制剂公告!

根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),我中心组织遴选了第四十三批参比制剂(见附件),现予以公示征求意见。
公示期间,请通过参比制剂遴选申请平台下“参比制剂存疑品种申请”模块向药审中心进行反馈,为更好服务申请人,反馈意见请提供充分依据和论证材料,反馈材料应加盖单位公章,并提供真实姓名和联系方式。
公示期限:2021年5月13日~2021年5月26日(10个工作日)。






 个人中心
个人中心
 我是园区
我是园区




