
 来源:NMPA官网
来源:NMPA官网
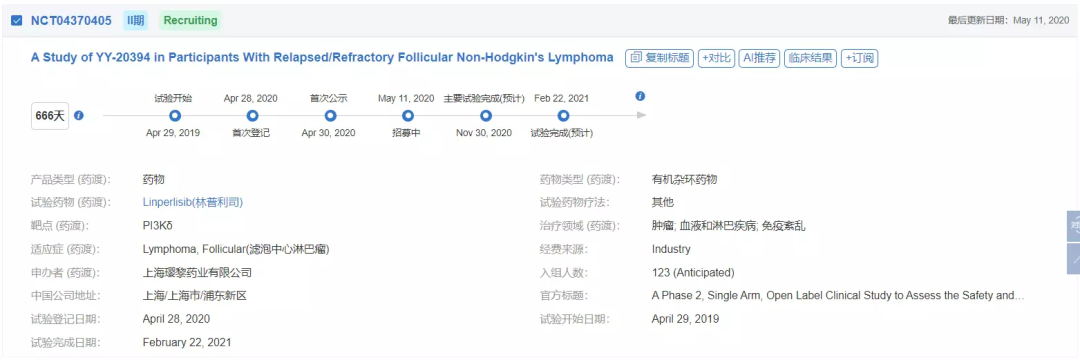
此次获批主要是基于一项名为YY-20394-002临床研究的积极结果。本研究(NCT04370405)是一项单臂、开放、多中心II期临床试验,旨在评估林普利塞治疗复发和/或难治滤泡性淋巴瘤患者的安全性、耐受性和疗效。本研究共纳入93例接受过二线或二线以上全身系统治疗后进展(曾接受过美罗华和至少一个烷化剂治疗)的复发和/或难治滤泡性淋巴瘤患者。
 来源:药渡数据库
来源:药渡数据库
结果显示,林普利塞在89例(可评估病例)复发/难治滤泡性淋巴瘤的患者中,客观缓解率(ORR)达80%以上,疾病控制率(DCR)达95%以上;并且口服给药安全可控、耐受性好。恶心等常见的胃肠道不良反应和同类药物特别关注不良反应如腹泻、肝毒性等发生率低于同靶点药物文献报道。
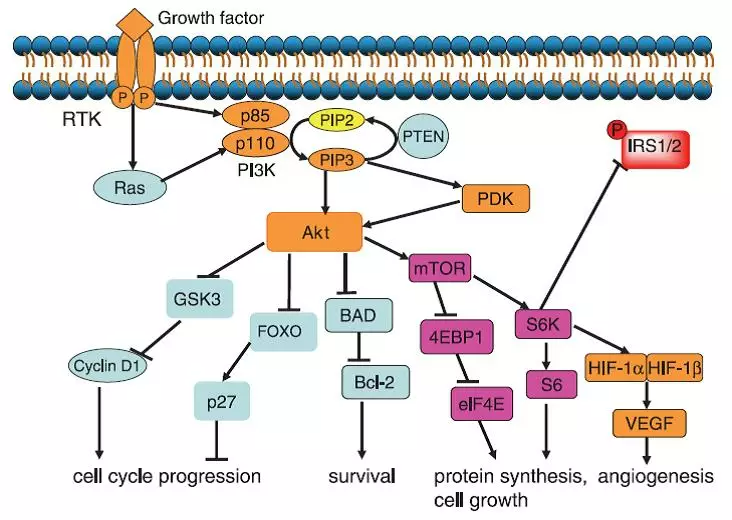
林普利塞是璎黎药业研发的新一代PI3Kδ(磷酯酰肌醇3-激酶亚型δ)高选择性抑制剂。林普利塞通过抑制PI3Kδ蛋白的表达,降低AKT蛋白磷酸化水平,从而诱导细胞凋亡,抑制恶性B细胞及原发肿瘤细胞细胞系的增殖。已有的临床数据表明,林普利塞具有良好的安全性和显著疗效,且患者每天只需口服一次。
 来源:璎黎药业官网
来源:璎黎药业官网
研发里程碑
2021年5月27日,林普利塞被NMPA纳入优先审评,用于既往接受过二线或二线以上全身系统治疗的复发或难治滤泡性淋巴瘤患者的治疗。
2020年9月3日,林普利塞获NMPA授予突破性疗法资格认定,用于治疗复发和/或难治滤泡性淋巴瘤。
2018年10月1日,林普利塞获FDA授予孤儿药资格认定,用于治疗滤泡性淋巴瘤(FL)。
2018年10月1日,林普利塞获FDA授予孤儿药资格认定,用于治疗慢性淋巴细胞白血病(CLL)和小细胞淋巴瘤(SLL)。
林普利塞高选择性、高依从性、安全可控等优势,吸引了国内医药巨头恒瑞的目光。2021年2月,恒瑞以2,000万美元认购璎黎药业6.67%的股份,同时与璎黎药业达成协议,上海璎黎药业授予恒瑞医药针对PI3kδ抑制剂林普利塞在大中华地区的联合开发权益以及排他性独家商业化权益。
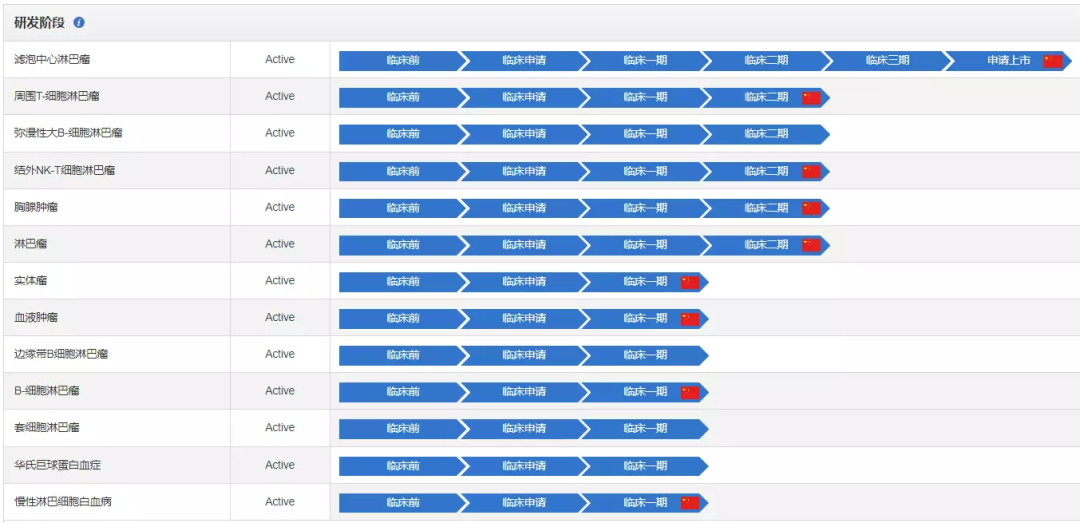
恒瑞的强势加入,促使林普利塞的临床开发进入加速阶段。根据药渡数据调研,林普利塞针对多项适应症的临床研究正在进行中。
 来源:药渡数据库
来源:药渡数据库
根据药渡数据统计,目前国外有4款PI3Kδ抑制剂获批上市,分别为吉列德的Idelalisib,Verastem的Duvelisib,拜耳的Copanlisib和TG Therapeutics的Umbralisib,目前只有Duvelisib于今年在国内获批上市。
 来源:药渡数据库
来源:药渡数据库
以吉列德Idelalisib(艾德拉尼)为例,自2014年上市以来,总销售额超过8亿美元, PI3Kδ抑制剂市场前景广阔。
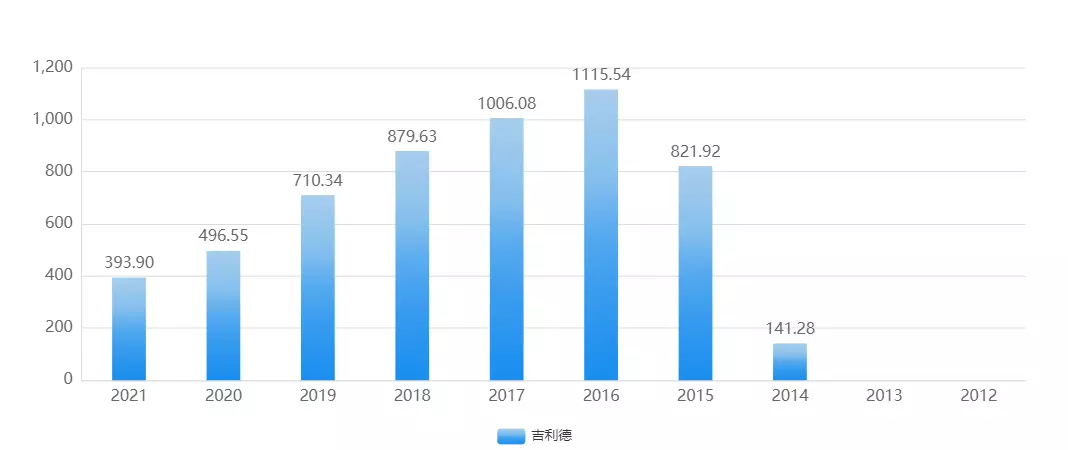 来源:药渡数据-全球销量库
来源:药渡数据-全球销量库
滤泡性淋巴瘤(Follicular lymphoma, FL)是一种起源于滤泡生发中心的惰性非霍奇金淋巴瘤(Non-Hodgkin’s lymphoma, NHL)。在我国FL约占NHL的8.1%〜23. 5%,中位发病年龄55〜60岁,发病率女性略高于男性。虽然该病呈惰性进展特点,中位生存期可达10年余,但大部分疾病最终会出现复发或转化,且目前仍不能被治愈。林普利塞作为一种安全性、有效性以及用药依从性上均优于同类已上市药品在国内上市,无疑是给国内FL患者带来新的治疗选择和希望。



 个人中心
个人中心
 我是园区
我是园区




