▎药明康德内容团队报道
4月21日,中国国家药品监督管理局药品审评中心(CDE)公示,复宏汉霖抗肿瘤产品斯鲁利单抗注射液以符合附条件批准的药品拟纳入优先审评,拟用于经过标准治疗失败的、不可切除或转移性高度微卫星不稳定型(MSI-H)实体瘤的治疗。根据复宏汉霖近期公告,推测该产品为其重组抗PD-1人源化单克隆抗体注射液HLX10。
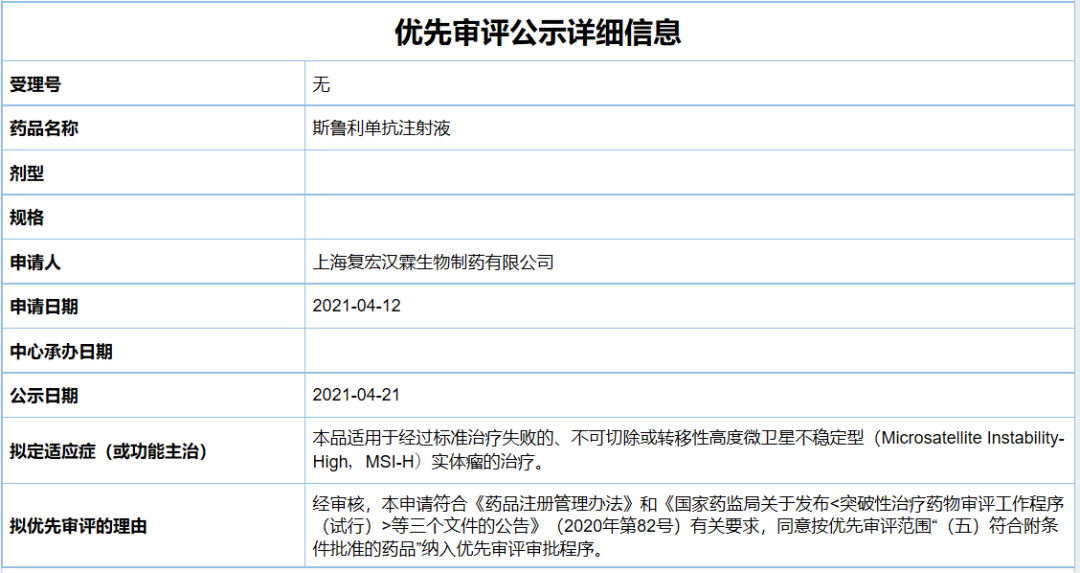 截图来源:CDE官网
截图来源:CDE官网
HLX10是复宏汉霖自主开发的创新型抗PD-1单抗,拟用于实体瘤及慢性B型肝炎(即慢性乙型肝炎)治疗,目前正在全球开展多项单药及联合疗法的临床研究。今年3月底,复宏汉霖发布公告称,HLX10在一项2期临床研究中达到主要终点,针对经标准治疗失败的、不可切除或转移性MSI-H或错配修复缺陷型(dMMR)实体瘤。该公司计划于2021年3月底或4月初就HLX10用于经标准治疗失败的、不可切除或转移性MSI-H实体瘤适应症向CDE递交上市注册申请(NDA)。
这是一项在标准治疗失败的、不可切除或转移性MSI-H或dMMR实体瘤患者中进行的,旨在评价HLX10疗效、安全性及耐受性的单臂、开放、多中心、2期临床试验。主要疗效终点为独立影像评估委员会依据RECIST v1.1标准评估的客观缓解率(ORR)。次要终点包括研究者评估的ORR,持续缓解时间(DoR),无进展生存期(PFS),总生存期(OS),安全性和耐受性。该临床研究结果表明了HLX10在该类适应症上良好的疗效和安全性。
MSI-H与dMMR是两种常见的遗传异常,含有这两种变异的肿瘤,细胞内的DNA修复机制往往会受到影响,不能正常发挥作用。带有这些异常的肿瘤分布非常广泛,可出现在结直肠、子宫内膜、胃肠道、乳腺、前列腺、膀胱、甲状腺等多个部位。因此,通过遗传变异特征而非病发部位来区分这些癌症,对于治疗有着更好的指导意义。
根据复宏汉霖早前发布的新闻稿,围绕HLX10,该公司采取差异化的“Combo+Global”开发战略,率先开展免疫联合疗法,目前已在中国、美国、欧盟等国家及地区获得临床试验许可,共计10项临床研究正在加速推进中,广泛覆盖MSI-H实体瘤、肺癌、肝细胞癌、食管癌、头颈鳞癌和胃癌等主要癌种,其中包括三项针对鳞状非小细胞肺癌、广泛期小细胞肺癌、胃癌新辅助开展的国际多中心3期临床。值得一提的是,HLX10联合化疗一线针对鳞状非小细胞肺癌适应症的上市注册申请也有望于今年下半年递交。
在开展国际多中心临床研究的同时,复宏汉霖还与PT Kalbe Genexine Biologics公司达成合作协议,授予其在HLX10首个单药疗法及两项联合疗法在东南亚地区10个国家的独家开发和商业化权利,以期惠及全球尤其是新兴市场的更多患者。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局药品审评中心. Retrieved Apr 21,2021, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=3
[2] 产品速递 | 复宏汉霖创新型抗PD-1单抗MSI-H实体瘤即将递交上市申请,2期临床研究达到主要终点 . Retrieved Mar28, 2021, from https://mp.weixin.qq.com/s/lqLDuZVKYOPKDHEhHPbnvg
[3] 自愿公告 - HLX10(重组抗PD-1人源化单克隆抗体注射液)用於经标准治疗失败的、不可切除或转移性高度微卫星不稳定型或错配修复缺陷型实体瘤的2期临床研究达到主要研究终点 . Retrieved Mar28, 2021, from http://www.cninfo.com.cn/new/disclosure/detail?stockCode=02696&announcementId=1209469100&orgId=fzqy1031451&announcementTime=2021-03-28
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。

 截图来源:CDE官网
截图来源:CDE官网




 个人中心
个人中心
 我是园区
我是园区




