▎药明康德内容团队编辑
今日,Zentalis Pharmaceuticals公司宣布,美国FDA已授予该公司的口服WEE1抑制剂ZN-c3快速通道资格,用于治疗复发或持久性子宫浆液性癌。快速通道资格旨在促进治疗严重或危及生命的创新疗法的开发和审评。值得一提的是,该公司已在中国成立合资公司
正腾康生物
,在中国开发这款创新疗法。

子宫浆液性癌是一种侵袭性严重的子宫内膜癌亚型,它虽然只在少于10%的子宫内膜癌患者中出现,但是导致80%的子宫内膜癌患者死亡。目前的标准治疗为手术外加化疗或放疗,但是在手术之后的复发率非常高。
ZN-c3是一款潜在“first-in-class”的WEE1口服抑制剂。WEE1是一种DNA损伤反应蛋白,抑制它的活性可以导致携带DNA损伤的癌细胞在损伤未修复的情况下进入有丝分裂,促进细胞的死亡。
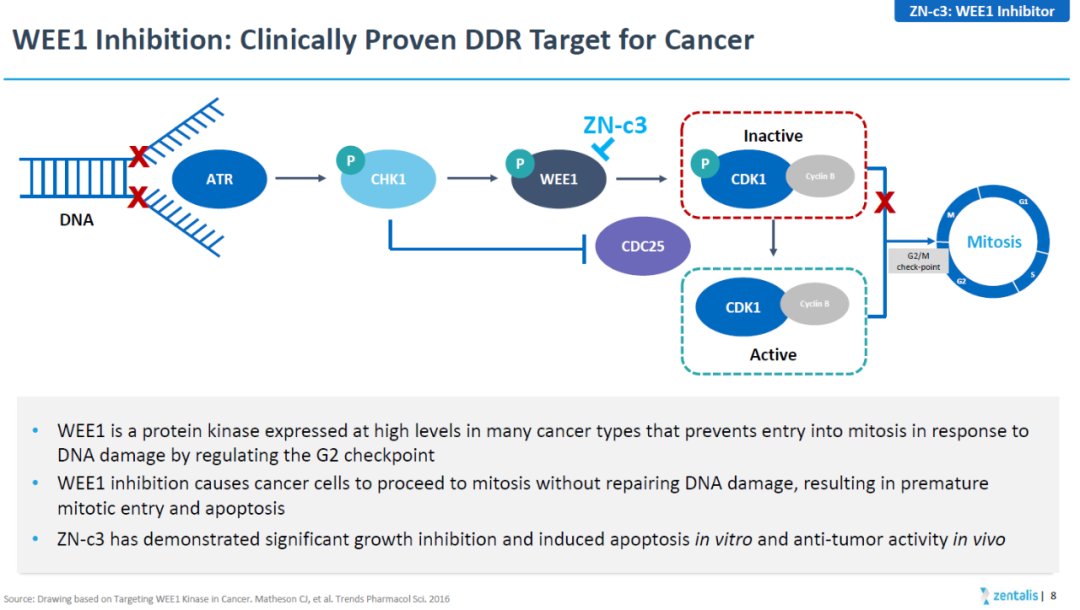
ZN-c3在临床试验中作为单药治疗多种实体瘤,已经表现出可喜的抗癌活性,在结直肠癌、非小细胞肺癌、卵巢癌和子宫浆液性癌患者中都观察到了部分缓解。
目前,在子宫浆液性癌中进行的潜在注册性2期临床试验正在进行中,截至今年5月15日,子宫浆液性癌患者的客观缓解率为43%(3/7)。

▲ZN-c3在多种实体瘤类型中表现出抗癌活性(图片来源:Zentalis公司官网)
“子宫浆液性癌的特点是复发率高,生存率低。ZN-c3获得快速通道资格是一个重要的里程碑,显示了对创新有效治疗选择的迫切需求。”Zentalis首席执行官Anthony Sun博士说:“我们很高兴有机会与FDA进行更频繁的交流,快速推动这款在研疗法的开发。”
参考资料:
ZENTALIS PHARMACEUTICALS ANNOUNCES FAST TRACK DESIGNATION GRANTED BY THE U.S. FDA TO ZN-C3 FOR THE TREATMENT OF UTERINE SEROUS CARCINOMA. Retrieved November 17, 2021, from https://ir.zentalis.com/news-releases/news-release-details/zentalis-pharmaceuticals-announces-fast-track-designation
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。









 个人中心
个人中心
 我是园区
我是园区




