Nat Metab | 李珊珊/余希岚团队发现醋酸调控细胞衰老的新机制
收藏
关键词:
新机制Nat细胞
资讯来源:BioArt + 订阅账号
发布时间:
2021-06-29

乙酰辅酶A是重要的碳代谢中间产物,通过连接分解代谢,合成代谢和能量生成来维持细胞生长、增殖、自噬、海马记忆等生物学过程
【1, 2】
。作为乙酰基团的供体,乙酰辅酶A可通过促进组蛋白乙酰化来调控染色体结构与基因表达。在快速增殖的细胞里,乙酰辅酶A主要来源于葡萄糖代谢;然而,在特定代谢压力情况下,细胞可利用醋酸作为替代碳源由乙酰辅酶A合成酶
(ACSS1、ACSS2)
生成乙酰辅酶A
【3】
。近年来,醋酸引起了科研工作者的极大兴趣。在诱导干细胞重编程中积累的醋酸会延缓细胞分化。在酿酒酵母的发酵过程中会积累高浓度的醋酸,加快细胞的衰老,缩短细胞寿命。最初,人们认为醋酸对细胞衰老的作用是由于降低了pH。然而,其它酸比如盐酸、柠檬酸等缺乏此效果,说明醋酸通过其它机制来调控细胞衰老
【4】
。
2021年6月28日,来自湖北大学省部共建生物催化与酶工程国家重点实验室李珊珊/余希岚团队在Nature Metabolism上以长文形式
(Article)
发表了题为
The SESAME complex regulates cell senescence through the generation of acetyl-CoA
的研究论文,
报道了醋酸通过增强SESAME复合体与乙酰转移酶复合体SAS之间的相互作用,特异性地促进端粒附近区域组蛋白H4K16乙酰化(H4K16ac)的水平,破坏端粒异染色质结构从而加速细胞衰老的分子机制。

SESAME复合体是李珊珊教授在酿酒酵母里纯化、鉴定并命名的一种由糖代谢酶组成的400 kDa的蛋白酶复合体
【5】
。该复合物以丙酮酸激酶Pyk1为催化亚基,通过磷酸化组蛋白H3T11来抑制基因表达、调控糖代谢和增强细胞抵抗氧化压力的能力。在今年1月份,该研究团队在Nature Communications上报道了SESAME复合物可通过催化端粒H3T11磷酸化,维持端粒的异染色质结构
【6】
(详见BioArt报道: Nat Comm | 李珊珊/余希岚团队揭示糖代谢酶调控端粒结构的新机制)
。
在本项研究中,李珊珊/余希岚研究团队以酿酒酵母里SESAME复合物中的Acs2亚基为主要研究对象,首次发现SESAME复合体可以与SAS复合体相互作用,SESAME复合物通过提供局部高浓度的乙酰辅酶A以及维持SAS复合物的稳定性来特异性地促进H4K16ac在端粒附近结合。H4K16ac促进溴区结构域蛋白Bdf1在端粒附近区域的结合,阻止Sir2从异染色质向常染色质区域扩散,维持端粒异染色质结构的完整性。然而在有醋酸存在的情况下,SESAME复合物的作用便发生了变化。醋酸可以特异性增强SESAME复合体和SAS复合体之间的相互作用从而特异性地增强端粒附近的H4K16ac,使得更多的Bdf1蛋白结合,导致Sir2从端粒区域滑落和端粒结构的破坏,从而加速细胞衰老
(图1)
。
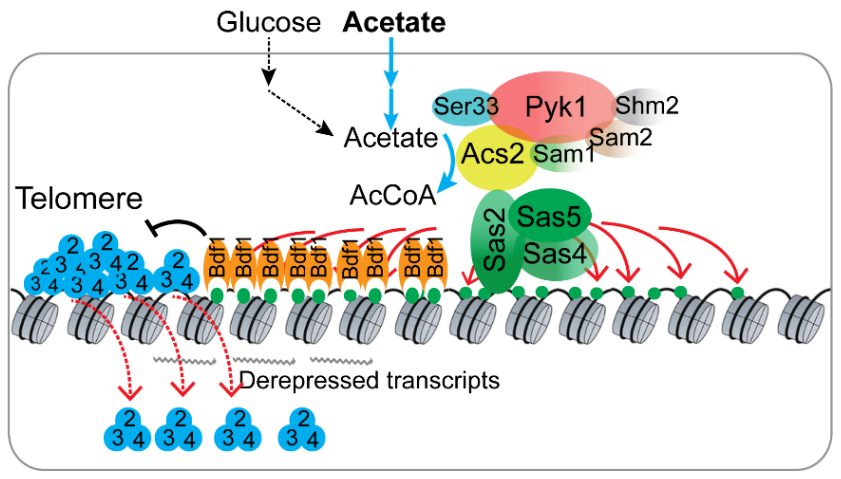
图1. 醋酸通过增强SESAME和SAS的相互作用破坏端粒异染色质沉默。
该团队博士研究生吴银盛进一步在血管内皮细胞里也发现醋酸不仅可加快血管内皮细胞的衰老,而且醋酸加速细胞衰老的机制在血管内皮细胞里高度保守
(图2)
。Acs2、Sas2的同源蛋白ACSS2和hMOF也有相互作用,共同介导醋酸对H4K16ac、端粒长度和细胞衰老的影响。过表达Sir2同源基因SIRT1可回复醋酸对衰老的影响。
该研究发现醋酸可促进血管内皮细胞衰老,揭示了醋酸调控细胞衰老的一种新的表观遗传学机制,为代谢调控与表观遗传机制研究提供了新的研究思路,为代谢干预衰老提供了重要的理论依据。
李珊珊/余希岚团队陈晚苹、吴银盛、唐杰、余奇、李鑫等完成了该项研究。南昌大学人类衰老研究所查梓彤、吕晓东参与了该研究。同时,美国斯托瓦斯医学研究所Jerry L. Workman教授,湖北大学马立新教授和陈建国教授以及武汉市第一医院中心实验室胡必成主任对该课题给与了大力支持。
https://doi.org/10.1038/s42255-021-00412-9
李珊珊课题组一直围绕糖代谢对细胞衰老和肿瘤发生的表观遗传机制研究,以通讯作者身份在Nature Metabolism、Nature Communications、Nucleic Acids Research、Oncogene等发表SCI论文10余篇。因工作需要,现招聘青年教师、博士后2-3名,待遇优厚。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
https://www.nature.com/articles/s42255-021-00412-9
1. Sivanand, S. et al. Spatiotemporal control of acetyl-CoA metabolism in chromatin regulation. Trends Biochem. Sci 2018, 43:61-74.
2. Mews, P. et al. Acetyl-CoA synthetase regulates histone acetylation and hippocampal memory. Nature 2017, 546:381-386.
3. Schug, Z.T. et al. Acetyl-CoA synthetase 2 promotes acetate utilization and maintains cancer cell growth under metabolic stress. Cancer Cell 2015, 27:57-71.
4. Burtner, C.R. et al. A molecular mechanism of chronological aging in yeast. Cell Cycle 2009, 8:1256-1270.
5. Li, S. et al. Serine and SAM responsive complex SESAME regulates histone modification crosstalk by sensing cellular metabolism. Mol. Cell 2015, 60:408–421.
6. Zhang, S. et al. Metabolic regulation of telomere silencing by SESAME complex-catalyzed H3T11 phosphorylation. Nat. Commun. 2021,12(1):594.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。







 药选址
药选址





