Biotech前瞻 / 北北
患者数量庞大的非酒精性脂肪肝炎(NASH)市场前景广阔,但却一直被视为研发行业的黑洞,足见该疾病领域药物进展之缓慢,研发难度之大。
2023年4月18日,Madrigal Pharmaceuticals宣布FDA授予Resmetirom治疗伴有肝纤维化的非酒精性脂肪性肝炎 (NASH) 患者的突破性疗法认定。拟将本季度内申报上市,也意味着具有研发黑洞之称的NASH领域,即将迎来重磅产品。

突破性疗法
早在2022年12月19日,Madrigal Pharmaceuticals 宣布其在研药物 Resmetirom 治疗 NASH 的 III 期临床 MAESTRO-NASH 研究达到主要终点和次要终点,并表示将在 2023 年上半年提交 NDA。
无独有偶,2022年9月22日,中国生物制药发布公告,公司下属企业正大天晴与法国生物科技公司Inventiva(IVA)签署协议,将获得治疗非酒精性脂肪性肝炎治疗药物lanifibranor在大中华区的独家许可权益,交易包括首付款1200万美元,临床及注册里程碑最高不超过4000万美元;以及商业化里程碑和销售净额的分层提成。该药物获得美国 FDA“突破性疗法”认证。
两条消息,将大众的视线聚焦到有着研发黑洞之称的NASH领域,本次聚焦NASH的流行病学和药物研发进展汇总。
非酒精性脂肪肝流行病学与更名争议
随着我国近30年来出色的乙肝防治工作,乙肝感染人数持续下降,NAFLD(非酒精性脂肪性肝病,俗称脂肪肝)已逐渐成为全世界最主要的慢性肝病之一。NAFLD是以肝细胞脂肪变性为主要特点的慢性肝脏疾病,多与代谢综合征相关,包括单纯性脂肪肝、非酒精性脂肪性肝炎(NASH)、NASH相关肝纤维化、肝硬化及肝癌,约20%~40% NASH患者可进展为肝硬化甚至肝癌。
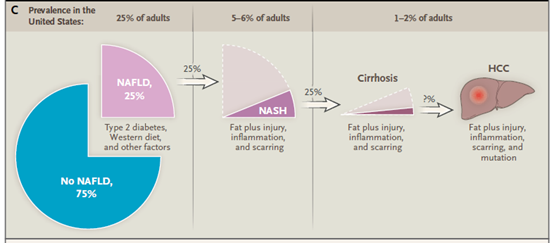
美国成年人群的患病率
我国NAFLD总体患病率约为29.2%,全球NAFLD的患病率约为25%,并有进一步升高的趋势,形式异常严峻。因此,近年来有关NAFLD的研究机制及应对策略的研究逐步增多。
且随着人们逐步意识到“非酒精性”一词所蕴含的内在缺陷,过分强调了有无酒精使用障碍,而忽视了代谢风险导致NAFLD进展的重要性,已经严重阻碍了这一疾病的诊断以及科学研究。因此,去年年初,国际脂肪肝专家小组在《Gastroenterology》上发布了非酒精性脂肪性肝病(NAFLD)更名和代谢相关脂肪性肝病(MAFLD)新定义的国际共识声明,但目前仍未得到业内一致认可,争议仍然比较大。
相信随着基于分子分型的个体精准化肿瘤治疗时代的到来,针对不同病因所导致的肝癌患者的诊断及治疗,会有更明确的判断。
NASH新药研究
全球针对 NASH 适应症,目前已进入开发期的品种所对应的靶点如下图所示。
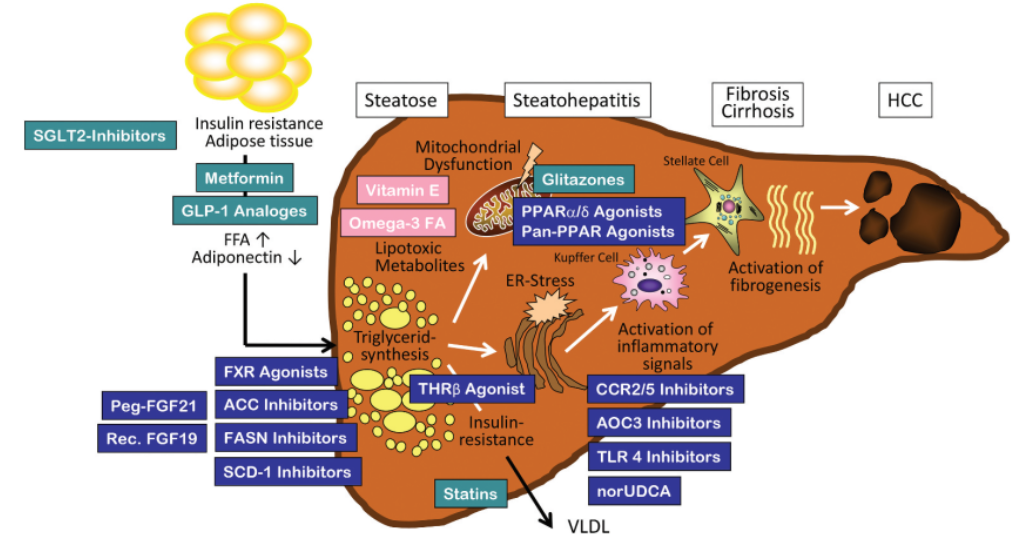
图2. NASH的发病机制和新的治疗靶点
但由于NASH具有发病机制复杂、临床诊断难度大,大多数治疗药物的Ⅱb期和Ⅲ期临床试验结果并未达到肝脏组织学终点,主要原因是当前对NASH异质性缺乏足够认识及治疗靶点仅仅聚焦下游,即使联用针对肝脏炎症损伤和纤维化不同靶点的药物也未必能够提高药物疗效。
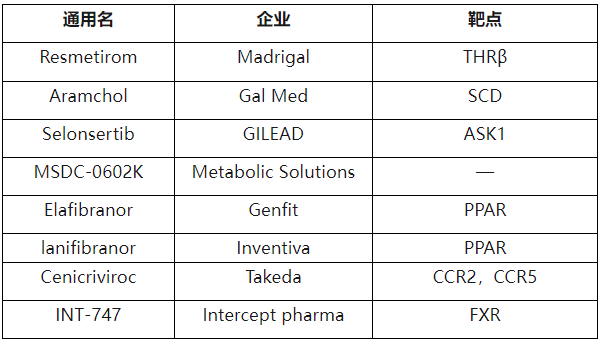
NASH药物研发进展
面对NAFLD/NASH广阔的市场前景和巨大的临床需求,药企都在寻求新机制、新靶点、新方案上的创新,以实现真正的行业突破。目前推进到临床III期的产品, 如上表所示,包括核受体激动剂,如FXR激动剂、PPAR激动剂、趋化因子受体抑制剂、甲状腺激素受体-β激动剂以及GLP-1、FGF 21或SGLT2抑制剂等。
Resmetirom
Resmetirom 是一款肝脏甲状腺素受体 β(THR-β)选择性激动剂,最初由罗氏公司开发,2008 年 Madrigal 获得该药的全球开发权。本次III期研究成功的Resmetirom是基于随机、双盲、安慰剂对照的MAESTRO-NASH 临床试验。该研究共纳入 966 名患者,以 1 : 1 : 1 随机分配接受 Resmetirom 80 mg、100 mg 以及安慰剂治疗。患者在基线与治疗 52 周时接受了肝脏活检评估。本次疗效分析评估了 955 名患者的情况,结果显示,研究达到双主要终点与一项关键次要终点:
在 NASH 症状缓解且纤维化不恶化终点上,80 mg、100 mg 两个剂量 Resmetirom 组的发生率为 26%、30% 均显著高于安慰剂组 10%(p<0.0001);在纤维化改善且 NAS 未出现恶化终点上,100 mg Resmetirom 发生率为 26% 与安慰剂组 14% 有显著性差异(p<0.0001)。
此外,在关键次要终点 24 周 LDL-C 水平下降的幅度上,80 mg、100 mg 两个剂量 Resmetirom 组分别为 -16%、-12%,与安慰剂组 1% 相比同样呈现出显著性差异(p<0.0001)。
在安全性方面,Resmetirom 具有良好的安全性与耐受性,与此前 III 期 MAESTRO 研究整体安全性一致。
Lanifibranor
Lanifibranor是一种口服的小分子PPAR激动剂,PPAR激动剂有益于葡萄糖和脂质代谢,用于治疗代谢综合征以降低血清甘油三酯和葡萄糖水平。Lanifibranor可通过激活三种 PPAR 亚型(α、β、γ)来诱导体内抗纤维化,抗炎以及有益的代谢变化。
目前,FDA 已授予lanifibranor用于治疗 NASH 的突破性疗法认证和快速通道资格,正在美国进行III期临床试验。这一次,就看中生的介入是否能重塑科兴疫苗的合作范例,在此不再引申。
NAFLD-HCC 无缘免疫治疗
近年来,随着免疫治疗时代的到来,对于靶向药物和化疗不敏感的肝癌,也带来了较大改变。基于IMbrave150试验的优异数据,阿替利珠单抗联合贝伐珠单抗(T+A组合)获批用于晚期HCC一线治疗,是索拉非尼获批肝癌一线治疗十余年来,首个显著优于索拉非尼的治疗方案。由此开启了肝癌领域的免疫治疗时代。免疫联合免疫,免疫联合靶向,以及双抗联合靶向药物等多项临床试验也在不断取得突破。在这些成绩值得肯定之际,也要正视高度异质性的肝癌免疫治疗的缺陷,尤其是非酒精性脂肪肝导致的肝癌患者,有报道称免疫治疗在此类人群中没有获益。
该结论来源于一篇发表在Nature 上的研究报道,研究团队对CheckMate-459、KEYNOTE-240和IMbrave150三项肝癌临床试验数据进行了分析,结果显示,HBV和HCV感染所致的肝癌患者,在三项研究中,免疫治疗后都有明确的总生存期(OS)获益(HR=0.64),但非病毒性肝炎所导致的肝癌,获益并不明显。
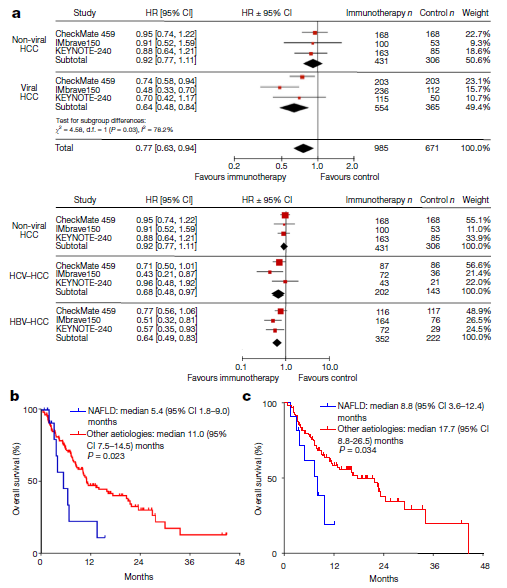
免疫疗法对HCC患者的疗效与疾病成因有关
进一步的队列分析发现, NAFLD成因的HCC患者接受免疫治疗后总生存期更短,另外一项118位HCC患者(11人患有NAFLD)的队列数据也是如此,合并NAFLD的患者OS远低于不合并患者。由此可之,合并脂肪肝的HCC患者,抗PD-1单抗治疗后,效果远低于病毒性HCC患者。
NAFLD-HCC的分子机制
NASH/NAFLD促进肝癌发生的机制目前尚不完全清楚,但多种肿瘤微环境因素,如促炎细胞因子升高、免疫细胞反应、脂肪代谢失调、肠道微生物群改变等,均可引起或协同促进肝癌的发生发展。
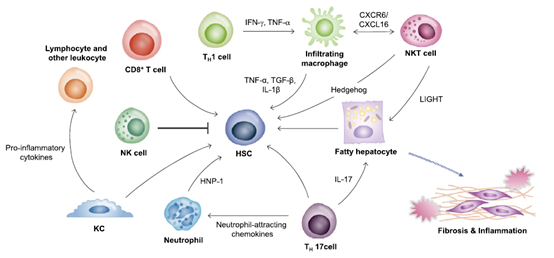
NAFLD的免疫微环境
并且值得一提的是,上述团队进一步研究发现。在NASH的影响下,肝脏内会积累大量CD8/PD-1双阳性的异常T细胞,如果PD-1/L1抑制剂激活的是这些T细胞,不仅不能杀伤肿瘤,反而会加剧肝组织的损伤。
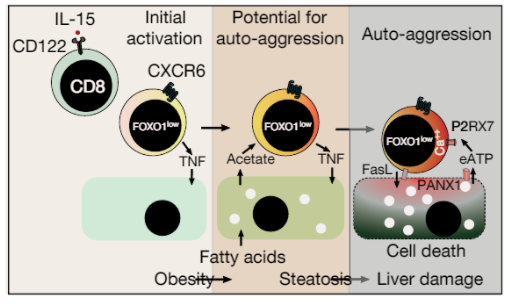
NASH中CXCR6 + CD8 T细胞自我攻击模型
原因可能是NASH患者肝脏中的CD8 T细胞,不是被某些病原体激活的,而是被代谢刺激激活的,CD8 T细胞发生了自身攻击性(Auto-aggression),会杀死各种类型的肝细胞,促进了NASH患者肝癌的发生,同时,也可能导致其他器官的组织损伤。
参考资料:
1. N Engl J Med 2017;377:2063-72. DOI:10.1056/NEJMra1503519.
2. Journal of Hepatology 2020 vol. 73 j 202–209.
3. Pfister D, Núñez N G, Pinyol R, et al. NASH limitsanti-tumour surveillance in immunotherapy-treated HCC [J]. Nature, 2021.
4. Expert Review of Clinical Pharmacology. 2021, 14(3): 333-340.
声明:本稿件为转载,仅用于分享,不代表本公众号立场,如涉及版权等问题,请尽快联系我们,我们将第一时间更正或删除。本文仅为作者观点,不构成任何投资建议,且非治疗方案推荐。

往期回顾
|
1 |
|
|
2 |
|
|
3 |
|



 个人中心
个人中心
 我是园区
我是园区