▲点击上方的蓝色“医谷”关注我们
“置顶公众号”获取最有价值行业趋势信息
医谷微信号:yigoonet
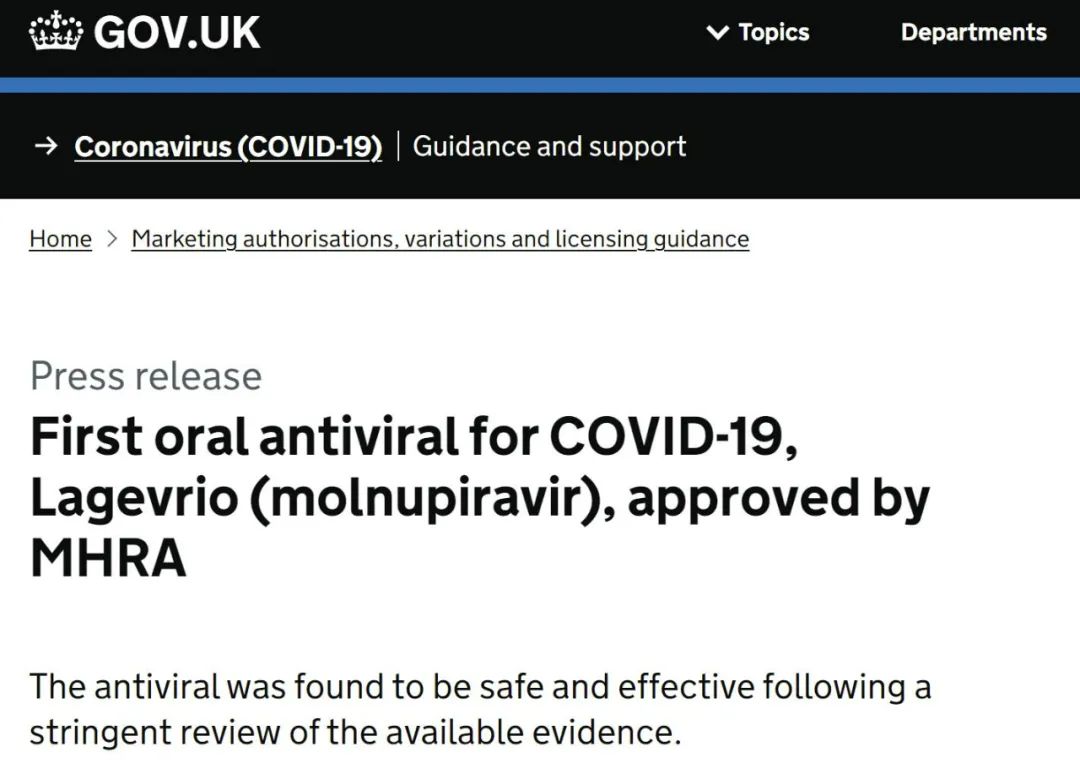
当地时间11月4日,英国药品和健康产品管理局(MHRA)宣布批准默沙东和Ridgeback公司研发的治疗COVID-19的口服抗病毒药物Molnupiravir上市,用于治疗轻至中度COVID-19成人患者。
英国卫生和社会保健部长 Sajid Javid 说:“今天对我们国家来说是历史性的一天,因为英国成为世界上第一个批准可以在家中治疗 COVID-19 的国家,对于最脆弱和免疫抑制的人来说,这将是一个改变游戏规则的时刻,他们很快就能接受开创性的治疗。”
Molnupiravir:首个获批的口服治疗COVID-19的抗病毒药物
Molnupiravir是针对RNA病毒的小分子广谱抗病毒口服药,可抑制新冠病毒的复制。10月1日,默沙东和Ridgeback公司宣布,在对有暴露风险的、轻度至中度新冠肺炎非住院成年患者开展的MOVe OUT临床试验的中,在研抗病毒口服药物Molnupiravir(MK-4482,EIDD-2801)显著降低了住院或死亡的风险。Molnupiravir将住院或死亡的风险降低了约50%;接受Molnupiravir治疗的患者中,有7.3%的患者在随机入组后至第29天期间住院或死亡(28/385),而接受安慰剂的患者的这一比例为14.1%(53/377);P值为0.0012。截至第29天,接受Molnupiravir治疗的患者没有死亡报告,而接受安慰剂的患者有8例死亡。
另根据有可用病毒测序数据的受试者(约40%的受试者),Molnupiravir 在不同的病毒变体Gamma、Delta和Mu中显示出一致的疗效。
不良反应方面,所有不良事件在Molnupiravir 组和安慰剂组中的发生率相当(分别为35%和40%)。同样,药物相关的不良事件发生率也相当(分别为12%和11%)。Molnupiravir 组(1.3%)因不良事件而中止研究治疗的受试者少于安慰剂组(3.4%)。
在独立数据监查委员会的建议下,经与美国食品药品监督管理局(FDA)磋商,由于上述积极的结果,这项研究的招募工作提前终止。
2021年10月11日,默沙东和Ridgeback公司宣布已向美国食品药品监督管理局(FDA)提交了Molnupiravir(在研口服抗病毒药物)的紧急使用授权申请(EUA),用于治疗有发展为重度风险和/或住院风险的轻度至中度新冠肺炎成年患者。
2021年10月25日,默沙东和Ridgeback公司宣布,欧洲药品管理局(EMA)启动对Molnupiravir的滚动审评。
基于对研究结果的信心,默沙东已经在冒险提前生产Molnupiravir,预计2021年内能够生产足够1000万疗程使用的药物,2022年还将继续加大药物供应量。今年6月,默沙东与美国政府签订协议,一旦获得FDA的紧急使用授权或者正式批准,将向美国政府提供170万疗程的molnupiravir药物,价值12亿美元(约77亿人民币)。
Molnupiravir成功了,罗氏却失败了
近日,罗氏和Atea Pharmaceuticals宣布,其新冠口服药AT-527全球II期试验MOONSONG未达到主要终点。公告发布当日,Atea股价暴跌66%,罗氏微跌1.64%。
AT-527由Atea研发,为RNA聚合酶抑制剂,可特异性抑制病毒RNA依赖性RNA聚合酶,进而抑制病毒复制和转录,因此对新冠病毒具有独特的双重抑制机制,目前其体外和体内抗病毒活性已在几种单链RNA病毒(包括人类黄病毒和冠状病毒)中得到证实。去年10月,罗氏以3.5亿美元首付款获得了该药物在美国以外的开发和商业权利。
AT-5272的II期临床试验主要用于治疗需要住院的中度COVID-19患者和未住院的轻度至中度COVID-19患者,主要临床终点为病毒RNA水平。此次公布的数据显示,AT-5272在550mg剂量1100mg剂量下,在轻中度低风险患者中病毒载量较基线的变化与安慰剂组相比,并未明显降低,未能到达研究的主要终点。

不过对于有潜在健康问题(基础疾病)的高危患者,550 mg和1100 mg剂量组在第七天时,病毒载量相对基线降低0.5 log10单位。

罗氏和Atea方面认为,在临床入组病人上的选择过于宽泛可能是导致临床失败的原因,导致与对照组相比,差异并不显著。目前双方计划在修改临床和目前患者人群后重新评估对COVID-19非住院患者的临床试验,预计2022 年下半年获得该试验的数据。
多家药企布局已进入研发后期
目前,在新冠口服药开发方面,辉瑞、日本盐野义、开拓药业等也在加强布局并处于研发后期。
辉瑞方面,3CL蛋白酶抑制剂PF-07321332 +利托那韦疗法将在年底前迎来III期数据揭盲,PF-07321332在多种冠状病毒的生命周期中起到重要作用,其潜在优势是对目前所有的新冠病毒变种都可以产生作用。
日本盐野义方面,同样是3CL蛋白酶抑制剂的S-217622目前正在进行轻度或无症状新冠感染患者的2/3期临床试验。
开拓药业方面,雄激素受体拮抗剂普克鲁胺将在11月中旬揭盲III期数据。
文 | 医谷





 个人中心
个人中心
 我是园区
我是园区




