生物前哨 / 清风
新冠肺炎mRNA疫苗的成功开发推动了mRNA工程和递送方面的创新。这些新技术可能会产生更稳定、表达更持久的下一代mRNA,这使得mRNA可能应用于蛋白质治疗和基因编辑领域。
此外,在mRNA递送方面的创新可以极大地提高mRNA在各种应用中的体内递送效率。
总之,这些创新将进一步促进mRNA疗法的临床翻译。而本文将就mRNA工程和递送的创新技术做一个简要介绍。
1
mRNA工程创新技术
自扩增mRNA
自扩增mRNA包含一个基于甲型病毒的复制子,可以放大编码蛋白的表达,因此在大多数应用中需要的剂量比传统的mRNA低得多。额外的复制子基因的加入使得自我放大mRNA的大小比传统的mRNA大。因此,用于常规mRNA的配方可能需要进一步优化以用于更大尺寸的自扩增mRNA。虽然核苷修饰被广泛应用于目前批准或目前研究的基于mRNA的治疗,但自扩增的mRNA不能包含这些修饰,因为它们可以干扰自扩增过程。自扩增SARS-CoV-2 mRNA疫苗已经证明它们能够在动物中诱导高滴度的中和抗体,目前有几个候选疫苗正在进行临床试验。在新冠肺炎疫苗中,它们可以在较低剂量下使用(1-10微克),而传统的 mRNA 剂量为30-100微克。
环状 RNA(circRNA)
通过核苷修饰和编码区和非编码区的优化可以显著提高mRNA的稳定性。环状RNA(circRNA)是通过反向剪接产生的具有闭合环结构的单链RNA,是一类具有潜在广泛生物学功能的非编码RNA。最近的研究表明,环状RNA的蛋白质编码功能在蛋白质翻译应用中具有很大的应用前景。由于缺乏核酸外切酶介导的降解所需的末端基序,独特的闭环结构使circRNA比线性mRNA具有更高的稳定性。一项开创性的研究表明,使用自剪接内含子构建的circRNA在真核细胞中显示出强大而稳定的蛋白质表达 (图1)。
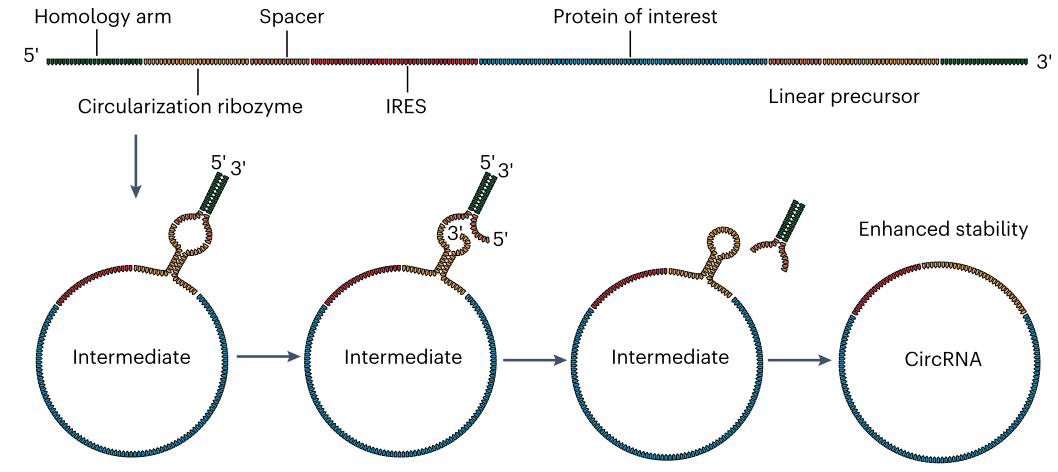
图1. 线性RNA前体的自我环化
除了增强稳定性外,circRNA引起的不良免疫反应比未经修饰的线性mRNA要少得多,因为它们不激活RNA传感器,如TLRs。circRNA疫苗已经证明比线性mRNA疫苗诱导出更高水平的中和抗体,在小鼠和恒河猴对SARS-CoV-2及其新出现的变种表现出强大的保护效果。
最近,含有载体拓扑、5’和3’UTRs、IRES和适配子五个关键元素的circRNA被构建,这些元素的同时优化导致了更高的circRNA蛋白产量。此外,几家公司正在探索circRNA的其他变体,例如优化的IRES。
2
mRNA递送的创新技术
新型mRNA递送系统
虽然LNPs是临床上最先进和应用最广泛的mRNA递送系统,但许多其他非LNP系统也具有巨大的潜力。逆转录病毒样蛋白PEG10可以选择性地结合和促进自身mRNA的囊泡分泌。
在此基础上,通过将感兴趣的基因(mRNA的DNA模板)插入到PEG10基因中而开发的PEG10病毒样颗粒(VLP)平台,通过将基因编辑工具输送到细胞而实现了有效的基因编辑(图2)。
PEG10-VLP平台的一个主要优势是其较小的免疫刺激和毒性,因为该平台是使用内源性人类蛋白构建的。
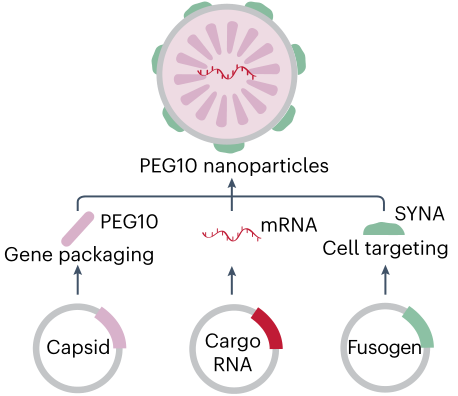
图2. PEG10病毒样颗粒平台
mRNA的内体逃逸是mRNA递送的主要挑战,使用可电离脂质可以改善这一点,另一种策略是直接将mRNA递送到细胞质中。
为此,Entos Pharmaceuticals公司开发了一种融合蛋白脂质载体平台,使用低毒中性脂类和专有的融合相关小跨膜蛋白。独特的融合相关小跨膜蛋白可以促进蛋白脂载体和细胞膜的快速融合,使mRNA能够直接输送到细胞质中(图3)。
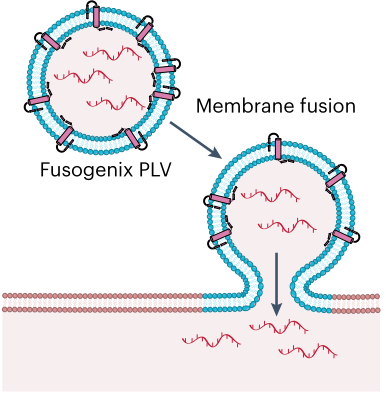
图3. 融合蛋白脂质载体平台
类似的,由相分离多肽形成的对pH和氧化还原反应的凝聚层绕过了经典的内吞途径,实现了mRNA在细胞内的直接递送和氧化还原的激活释放。
除了这些新平台,通过创新产生更强递送的LNPs。例如,利用组合文库鉴定的含有杂环脂的LNPs不仅能有效地将抗原mRNA递送到小鼠肿瘤中,而且还能通过干扰素基因刺激物(STING)途径促进抗原提呈细胞成熟,协同提高抗肿瘤效果。
LNPs的有效性可以通过引入不饱和脂类或炔类脂类来提高,而LNPs的硫醇基团或二磷酸基团的修饰使mRNA能够靶向输送到粘液或骨中。此外,一种单组分可电离的两亲性Janus树状大分子使mRNA能够有效地输送到不同的器官,有望简化目前的四组分LNPs系统。
以生物膜为基础的mRNA载体
基于生物膜的载体代表了另一种新型的生物相容的mRNA递送平台。不同类型的生物膜系统,包括细胞膜小泡、细菌来源的外膜小泡和细胞外小泡 (例如,外泌体)已被用于体外和体内递送治疗性mRNA。
作为一种纳米尺度的胞外囊泡,外泌体作为药物载体已被广泛研究。例如,Codiak BioSciences已经启动了一种名为exoSTING的基于外泌体人体试验,用于治疗实体肿瘤(NCT04592484)。在一项临床前研究中,基于外泌体的mRNA疫苗在小鼠中诱导了强大的IgG和分泌性IgA反应,这比基于脂质体的疫苗诱导的反应更强。
因此,生物相容的外泌体可能是mRNA传递的一个很有前途的平台。目前将mRNA用于蛋白质替代疗法的临床应用面临的一个主要挑战是短期内重复给药造成的潜在毒性。然而,与大多数现有的平台相比,生物囊泡的免疫原性和毒性较小,这使得它们在临床试验中特别适用于重复注射mRNA。
器官或细胞特异性的mRNA的递送
大多数纳米颗粒在静脉注射后优先积聚在肝脏中。因此,靶向非肝组织输送mRNA将极大地拓宽mRNA疗法的应用范围。为此,开发了一种选择性器官靶向(SORT)纳米颗粒平台,用于组织特异性mRNA的递送。
通过在广泛使用的四组分LNP系统中添加一种补充的阳离子、阴离子或可电离脂质分子,已经实现了选择性地将mRNA输送到小鼠的肺、脾或肝脏,从而实现了有效的CRISPR-Cas9基因编辑(图4)。
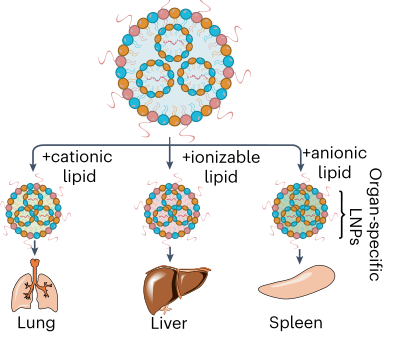
图4. 选择性器官靶向(SORT)纳米颗粒平台
除了靶向器官外,选择性地将mRNA输送到特定类型的细胞可以实现更精确和有效的治疗。针对特定细胞类型的mRNA递送的一种策略是开发LNPs或聚合物纳米颗粒。例如,优化的LNPs和聚合物已经用于将mRNA靶向递送到T细胞用于癌症免疫治疗。
另一种策略是使用细胞特异性配体。为了能够向炎症性肠病小鼠的Ly6c+炎性白细胞靶向递送治疗性mRNA,使用名为称为“Anchored Secondary scFv Enabling Targeting” (ASSET)模块化靶向平台将抗Ly6c靶向配体连接到LNPs上。该平台的一个优点是可以根据不同的应用更换不同的靶向抗体。
吸入、鼻腔或口服mRNA
可吸入递送使mRNA药物在肺部快速和选择性地积累,为治疗自当前新冠肺炎大流行开始以来一直流行的与肺部相关的疾病提供了巨大的潜力。使用基于hPBAE的纳米制剂证明了可以将mRNA吸入到肺中,使得小鼠肺中荧光素酶蛋白的高表达。
随后使用hPBAE平台已经实现了Cas13a mRNA高效地输送到小鼠和仓鼠的肺部,使得流感RNA病毒的降解以及SARS-CoV-2的复制减少和感染症状减轻。
作为另一种非侵入性的给药方法,鼻腔注射疫苗可以诱导对呼吸道病原体的粘膜免疫,使其成为SARS-CoV-2疫苗的一种有前途的给药方法。已经证明鼻腔注射SARS-CoV-2 mRNA疫苗可以保护小鼠免受SARS-CoV-2感染,这在肺中表现为较低的病毒滴度和较少的组织损伤。
肌肉注射是目前获得批准的新冠肺炎疫苗的主要给药途径,但受到对医务人员或制药人员的限制,这可能会对疫苗的推出产生负面影响。口服给药为新冠肺炎疫苗的接种提供了一种有前景和有吸引力的替代方案。已经证明口服5型腺病毒SARS-CoV-2疫苗可以成功地降低SARS-CoV-2感染仓鼠模型中的疾病严重性和传播率,一期人体临床试验已经正在进行(NCT04563702)。
BioNTech和Matinas BioPharma最近宣布了一项独家研究合作,利用新型脂质纳米晶体平台开发潜在的口服mRNA疫苗。这种脂质纳米晶体是一种稳定的包含多层的结晶纳米颗粒,通过钙和阴离子磷脂的相互作用而形成,在此过程中,可诱导mRNA加载到这些层中。
参考资料:
1.The landscape of mRNA nanomedicine.
2.Circular RNA: An emerging frontier in RNA therapeutic targets, RNA therapeutics, and mRNA vaccines.
声明:本稿件为转载,仅用于分享,不代表本公众号立场,如涉及版权等问题,请尽快联系我们,我们将第一时间更正或删除。本文仅为作者观点,不构成任何投资建议,且非治疗方案推荐。

往期回顾
|
1 |
|
|
2 |
|
|
3 |
|



 个人中心
个人中心
 我是园区
我是园区