Cancer Res | 整合多组学揭示低级别浆液性卵巢癌中MEKi治疗敏感相关标志物及新型治疗靶标
收藏
关键词:
治疗癌揭示
资讯来源:精准医学与蛋白组学 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2021-01-22
编者按:
卵巢癌是最常见的女性生殖系统肿瘤及恶性妇科肿瘤之一,其恶性程度高,预后效果差。我们已详细解读过很多有关卵巢癌的重要研究成果,如Nat Comm 及Cell Reports 分别报道的
低级别浆液性卵巢癌
(Low-grade serous ovarian carcinoma, LGSOC)
是一种罕见的肿瘤亚型,在转移性疾病患者中的致死率很高。LGSOC女性患者通常在疾病晚期才被确诊,且80%-90%的患者生存期不超过10年。许多研究表明,与其他卵巢癌亚型相比,LGSOC的点突变非常少,其中较为关键的是KRAS
(20%-40%)
,NRAS
(7%-26%)
,BRAF
(5%-33%)
,TP53
(<8%)
的突变,CDKN2A
(15%-53%)
的缺失,雌激素受体
(ER)
和孕激素受体
(PR)
的高表达,以及近期才发现的潜在因素---USP9X
(15%)
,EIF1AX
(8%)
的突变。
目前LGSOC的传统治疗方法通常是先进行减瘤手术
(cytoreductive surgery)
,再进行铂/紫杉醇化疗,但效果并不理想。只有识别LGSOC中导致MAPK基因 (RAS/RAF/MEK) 突变的致瘤基因,才能对治疗药物如MEK抑制剂
(MEKi)
的效果进行评估。有研究已经表明,MEKi对LGSOC复发患者的生存期有显著改善作用
[1]
,但其中改善的具体机制还需要进一步阐明。所以,迫切需要通过多组学整合方法描绘肿瘤图谱,为更好识别分子疾病及开发新的特异性有效治疗方法提供新的可能。
2021年1月13日,温哥华不列颠哥伦比亚大学
Colin C. Collins
课题组和
Mark S. Carey
课题组联合在Cancer Research 上发文 [2],针对14种临床表征的LGSOC细胞系模型进行了
基因组、转录组和蛋白质组的整合分析,表征了LGSOC模型的分子复杂性,鉴定了肿瘤新型标志物,也识别和预测了MEKi治疗下的分子生物标志物
,为开发有效药物治疗方法提供依据。
研究首先使用全面覆盖的外显子测序
(WES)
对来自11个位患者的14个LGSOC细胞系及对应的10个正常样本进行了研究。在其中三个患者治疗过程中,分别收集了来自肿瘤和腹水的不同时间点的2个不同的细胞系
(样本策略)
。从14个细胞系中鉴定出蛋白质编码区的1,893个高确定性非沉默突变。
通过一系列研究发现,在MEKi敏感细胞系中,KRAS、NRAS、BRAF的不同位点有不同程度的突变,MEKi耐受细胞系中,TP53 (R234H) 突变,但LGSOC肿瘤中很少突变
。
研究进一步利用近期开发的计算算法HIT'nDRIVE,根据SNV-mRNA
(单核苷酸变异, single nucleotide variations)
表达数据库和CAN-mRNA
(拷贝数畸变, Copy number aberrations, CAN)
表达数据库,从LGSOC细胞系中识别了驱动基因,并且比对了染色体9p21的mRNA和蛋白质表达数据,
结果发现MTAP, CDKN2A, CDKN2B是LGSOC细胞系中共有的驱动基因。
通过在GENIE
(体细胞突变的LGSOC肿瘤, n=97)
中进行LGSOC肿瘤的CAN分析,发现肿瘤中31.5%的CDKN2A/B 和MTAP 缺失,其中几乎没有纯合缺失
(7.4%)
。
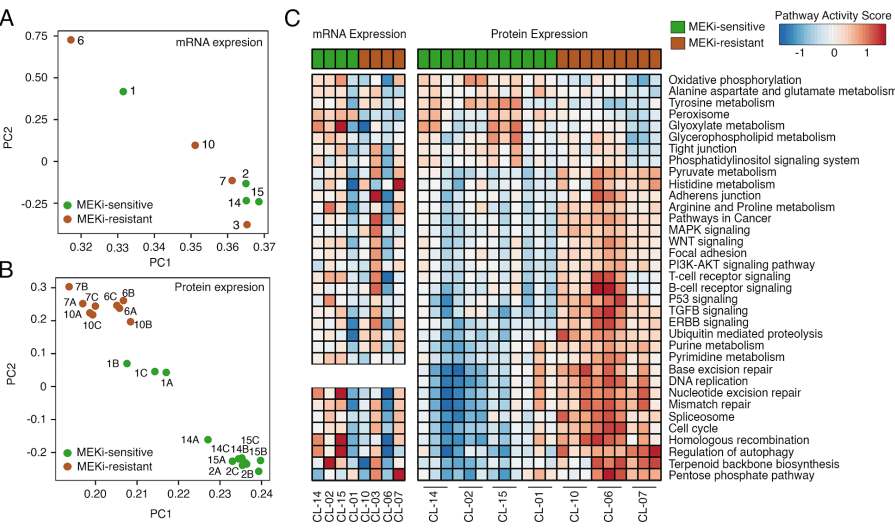
接下来,研究对MEKi耐受/敏感性的8个LGSOC细胞系进行了总RNA测序,平均检测到1,430万条读数,以及超过27,700个独特表达的基因。主成分分析
(PCA)
表明,MEKi耐受/敏感性细胞样本之间不能明显的聚类/区分
(图1A)
。相反地,在对7个LGSOC细胞系进行基于质谱的蛋白质组学分析
(质谱策略)
,鉴定到5,110个独特的蛋白质后,PCA分析显示出了MEKi耐受/敏感性细胞系分别聚集在两个不同簇
(图1B)
,
这证明LGSOC细胞系的蛋白质表达谱比其mRNA表达谱能更好地区分MEKi敏感和MEKi耐受表型。
随后,研究者识别了两种细胞系表型之间差异性表达的转录组和蛋白质组数据,分别鉴定出1,231个差异表达基因,1,202个差异表达蛋白质,其中有113个基因/蛋白重合,包括EGFR,PRCKA,MAPK4,NF2,MTOR,MTAP,ATM,TGFB2和BRCA2。将差异表达的基因/蛋白质进行过表达并富集之后,发现它们富集在了相似的信号通路上
(图1C)
。其中MAPK、Wnt、P53,DNA复制/修复、细胞周期过程和氨基酸代谢等通路上的大部分蛋白质在MEKi耐受细胞系中高表达,氧化磷酸化和紧密连接通路中的大部分蛋白质在MEKi敏感细胞系中高表达。通路分析同样表明了蛋白质表达谱比mRNA表达谱更能将MEKi不同反应表型区别开来,因此接下来集中于蛋白质表达数据的分析。
图1 MEKi不同反应表型的转录组和蛋白质组谱表征
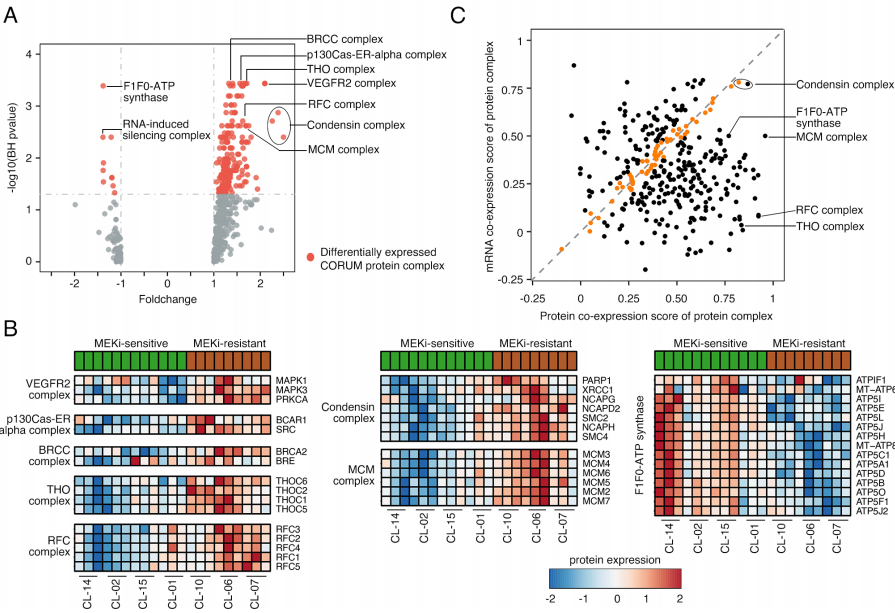
为了识别两种细胞系中的蛋白质复合物,研究使用了来自CORUM数据库的核心蛋白复合物数据集,并对其中平均蛋白表达谱进行了Wilcoxon秩检验。
在MEKi耐受细胞系中识别了一些高表达的蛋白质复合物,如BRCC,p130-ER-alpha,VEGFR2,Condensin,微染色体维持
(MCM)
和复制因子C
(RFC) (图2A-B)
。在MEKi敏感细胞系中识别了高表达的F1F0-ATP合酶复合物和RNA诱导的沉默复合物
(RISC)
。
通过计算343种蛋白质复合物的共表达分数,发现56种具有mRNA和蛋白质共表达
(图2C)
,其中28种蛋白质复合物共表达得分较高
(如Condensin)
,而MCM和RFC复合物具有较强的蛋白质共表达,但较弱的mRNA共表达。
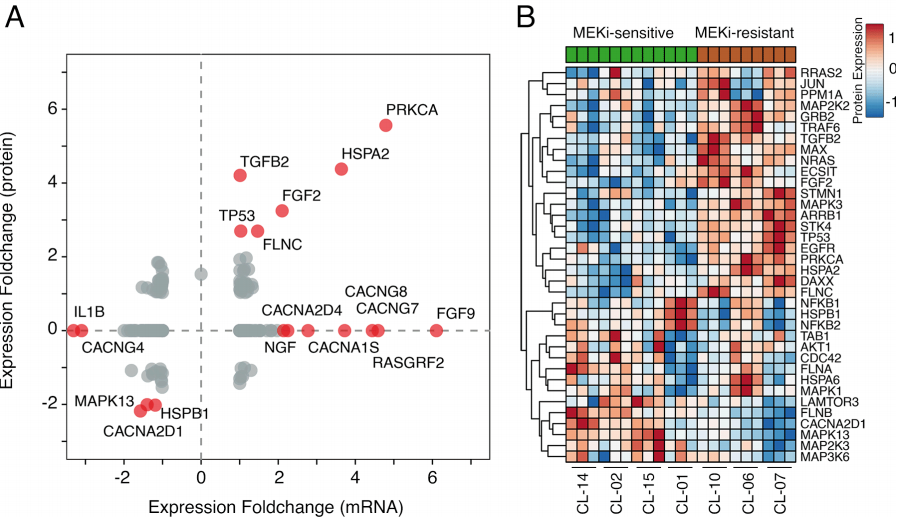
有报道称MEKi治疗在一些无法治愈的LGSOC患者中显示出活性,所以研究进一步调查了有关MAPK通路的活性。首先,将这条通路上倍数变化的mRNA和蛋白质表达相关联
(图3A)
。
结果表明,在MEKi耐受细胞系中,基因如PRKCA,HSPA2,TGFB2,FGF3,TP53和FLNC 均上调,并且它们高度相关
(图3B)
。另一方面,MEKi敏感细胞系中MAPK13,HSPB1 和CACNA2D1 被上调。
此外,相比MEKi敏感细胞系,MEKi耐受细胞系中RAS-RAF-MEK-ERK和PI3K-AKT-mTOR通路发生了很大的变化。
图3 MAPK信号通路的蛋白质组表达谱表征了LGSOC对MEKi治疗的反应
本研究使用蛋白基因组学方法,对14个LGSOC细胞系进行研究,以揭示LGSOC的新型生物标志物及治疗靶标。研究还
将LGSOC细胞系数据与LGSOC肿瘤数据进行比较,通过监测生物标记物变化,预测了MEK抑制剂
(MEKi)
的功效。
结论1:
仅在MEKi敏感细胞系中发现KRAS 突变,而在MEKi耐受细胞系中主要发现NRAS 突变。
结论2:
在MEKi敏感和MEKi耐受细胞系中鉴定出COSMIC突变特征的不同模式。相比肿瘤样本,在细胞系中更容易出现CDKN2A/B 和MTAP 基因的缺失,这可能预示着在KRAS/NRAS/BRAF 没有突变情况下具有关键驱动机制。而在预测体外MEKi的功效上,蛋白质组学数据提供了比基因表达数据更好的辨别力。
结论3:
凝缩蛋白
(Condensin)
,MCM和RFC蛋白复合物被确定为MEKi耐药细胞系中的潜在治疗靶标。
结论4:
本项研究表明CDKN2A/B 或MTAP 基因缺失可以通过使用
合成致死
(synthetically lethal)
策略,突出了蛋白质组学作为分子药物预测工具的重要性,并且多元组学方法对于增进对LGSOC分子基础的理解以及将其用于开发新疗法至关重要。
1. Gershenson DM, et al. 2019. A randomized phase II/III study to assess the efficacy of trametinib in patients with recurrent or progressive low-grade serous ovarian or peritoneal cancer. Ann Oncol.
2.
Raunak Shrestha, et al. 2021. Multi
omics characterization of low-grade serous ovarian carcinoma identifies potential biomarkers of MEK inhibitor sensitivity and therapeutic vulnerability.
Cancer Res.
本文由景杰学术团队报道,欢迎转发到朋友圈。如您需要搜索更多往期精彩内容,可点击公众号右上角人像标志后,在上方搜索框内通过关键词搜索相关内容。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
#关注领取
新人福利
,下载最近三年影响因子(后台发送关键词“新人”)







 个人中心
个人中心
 我是园区
我是园区




