

众所周知,由基因缺陷引起的血友病B,也被大家称之为“玻璃人”,因为他们撞不得、碰不得,一旦有伤口流血,便很难止住,甚至会带来生命危险。
11月23日,FDA批准了首款治疗血友病B成人患者的一次性基因疗法Hemgenix上市,用于治疗中重度至重度血友病B。
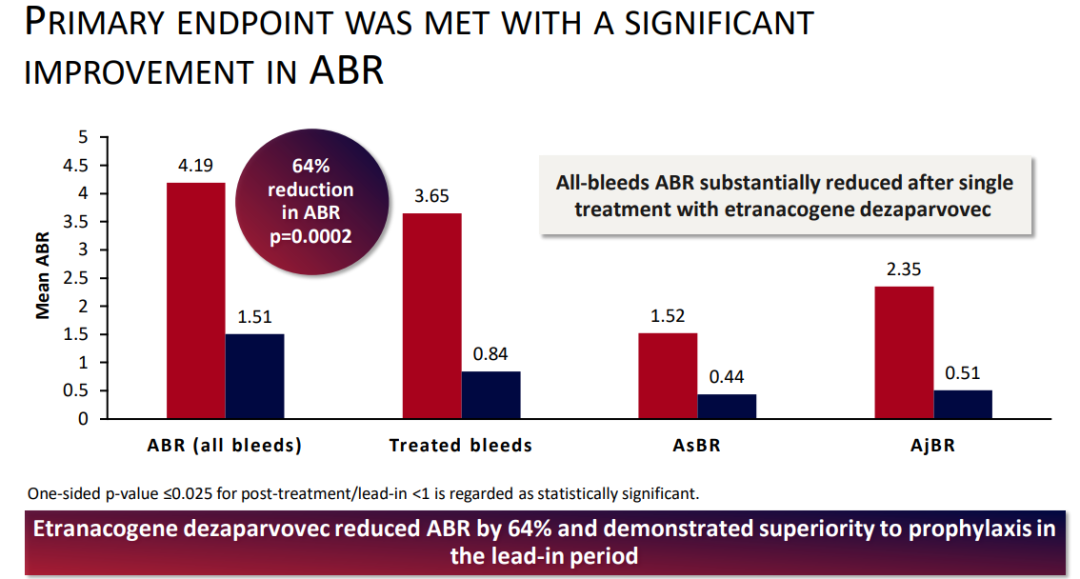
获批基于一项名为HOPE-B的试验数据,该试验是目前为止囊括患者最多的血友病B基因治疗试验,Hemgenix通过使患者自身持续产生因子IX,降低符合条件的血友病B患者的异常出血率。
该研究结果表明,Hemgenix在患者输注后6个月产生39%的平均因子IX活性,24个月产生36.7%的平均因子IX活性。输注后7至18个月,与因子IX预防性替代治疗的6个月导入期(4.1-1.9)相比,所有出血的平均调整年化出血率(ABR)降低。此外,94%的患者接受了Hemgenix治疗并停止使用预防性药物。
安全性方面,最常见的副作用(发病率≥5%)是肝酶升高、头痛、某种血液酶水平升高、流感样症状、输液相关反应、疲劳、恶心和感觉不适,但总体可控。
从该疗法机制来看,Hemgenix使用了腺相关病毒AAV5为载体,将因子IX的Padua基因变体(FIX Padua)携带到肝脏中的靶细胞,产生比正常高活性的因子IX蛋白。但该疗法并不会成为自身DNA的一部分,仅需注射一剂就可以在靶向细胞中,指导细胞器稳定持续地产生因子IX。
据悉,此疗法由荷兰生物技术公司UniQure开发,将由澳大利亚制药公司CSL Behring销售。在2021年5月,uniQure和CSL签订的协议中,前者为后者提供了Hemgenix在全球商业化和继续临床开发的专有权。为此,uniQure将获得4.5亿美元的预付款,并有资格根据监管和商业里程碑获得高达16亿美元的付款。
目前,uniQure已从CSL收到总额约5亿美元的付款,并有资格获得高达15亿美元的额外商业里程碑付款和分级费用。
CSL表示,在患有中度至重度血友病B的患者中,其一生中可能花费超过2000万美元的医疗保健系统。本月初,波士顿临床和经济评论研究所(ICER)在报告中表明,由于Hemgenix消除了患者昂贵的预防性治疗费用,并与其潜在的健康收益相互抵消,Hemgenix的定价将合理地超过290万美元,实际上,Hemgenix的成本仍然高于ICER的建议价格。最终,Hemgenix以定价高达350万美金,超越蓝鸟生物,打破了全球“天价药”记录,一跃成为当下治疗最昂贵的药物。
尽管定价高昂,但CSL在给Fierce Pharma的电子邮件中表明,该疗法将为整个医疗保健系统节省大量成本,实现降低年出血率,减少或消除预防性治疗以及产生持续多年的IX因子水平升高,长期来看可以显著降低血友病B患者的经济负担。
如今,被称为“可以一次治愈”的基因疗法已走过半个世纪。就针对疾病人群大多都是越治越少的罕见病这一点,尽管其疗效毋庸置疑,但对药企来说,如何确保长久的稳定收入增长以及可观的收益仍是一个难题。
以高价换取总量的策略是通行的做法,但商业闭环似乎并不容易建立。以蓝鸟生物为例,作为在基因疗法的浪潮中诞生的Biotech,一度颇受资本市场青睐。Hemgenix之前,蓝鸟生物已推出两款高昂的基因疗法Zynteglo和Skysona。但好景不长,2021年,Zynteglo因未能与德国政府达成价格协议,在欧盟市场节节败退,最终连带治疗脑性肾上腺脑白质营养不良的基因疗法Skysona以退出欧盟市场惨淡收尾。
迎接CSL的会是随着Hemgenix商业化的水涨船高,还是将重蹈蓝鸟生物高昂定价的商业化失败老路呢?一切还需要时间的验证。




 个人中心
个人中心
 我是园区
我是园区




