▎药明康德内容团队报道
中国国家药品监督管理局(NMPA)官网显示,阿斯利康(AstraZeneca)在中国申报的奥拉帕利(olaparib)新适应症上市申请已正式获批。公开资料显示,此次奥拉帕利获批的新适应症为:转移性去势抵抗性前列腺癌,此前已在中国被纳入优先审评。

奥拉帕利是阿斯利康和默沙东(MSD)联合开发的一款“first-in-class”PARP抑制剂。
该药靶向DNA损伤修复反应(DDR)通路,利用“合成致死“原理,在杀伤癌细胞的同时,不影响健康细胞。在中国,奥拉帕利(商品名:利普卓)于2018年8月首次获批,用于铂敏感复发性卵巢癌患者的维持治疗,是首个在中国获批上市的卵巢癌靶向新药。2019年11月,奥拉帕利再次获得NMPA批准,用于携带BRCA突变的晚期卵巢癌患者的一线维持治疗。
此次奥拉帕利在中国获批的适应症为前列腺癌,
具体拟定为:
携带
BRCA1/2
突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌
(mCRPC)
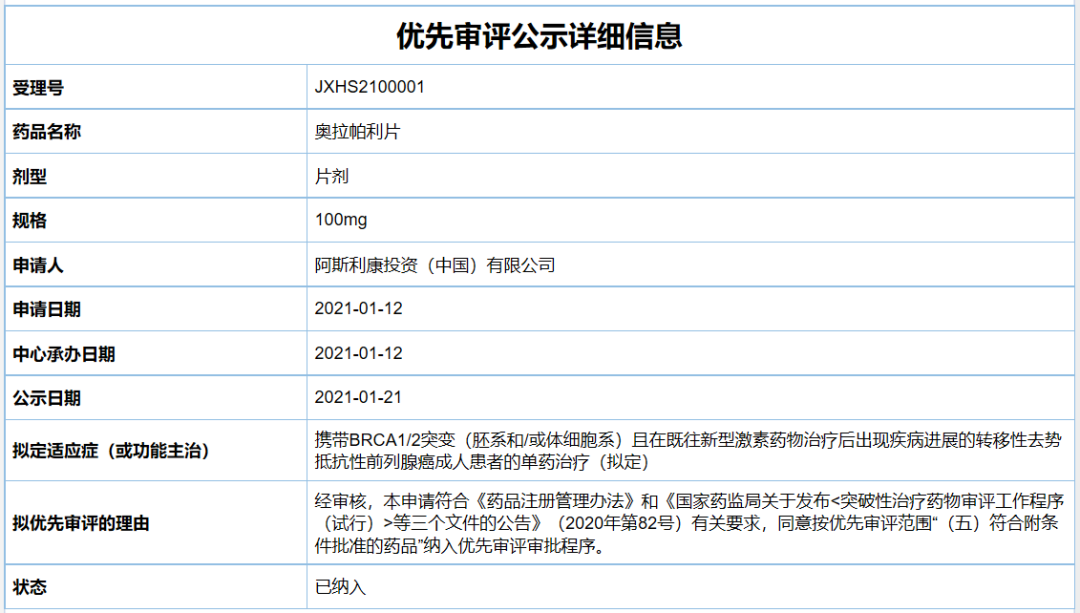
成人患者的单药治疗。值得一提的是,该适应症曾以“符合附条件批准的药品”被NMPA药品审评中心(CDE)纳入优先审评。
根据一项名为
PROfound的3期临床试验结果,在携带
BRCA1/2
或
ATM基因
突变(HRR基因突变亚群)的mCRPC患者中,
奥拉帕利
与
阿比特龙或恩杂鲁胺
相比,使患者的总生存期(OS)得到显著的改善,达到了该试验的关键性次要终点。此前公布的试验结果显示,在携带
BRCA1/2
或
ATM
突变的mCRPC患者中,与
阿比特龙或恩杂鲁胺
相比,
奥拉帕利
的治疗使患者的放射学无进展生存期(rPFS)显著延长,达到了试验的主要终点。
值得一提的是,PROfound研究最新分析数据,还在刚结束的2021年美国临床肿瘤学会(ASCO)年会上得以公布。研究在多个亚组中,均观察到奥拉帕利的抗肿瘤活性。
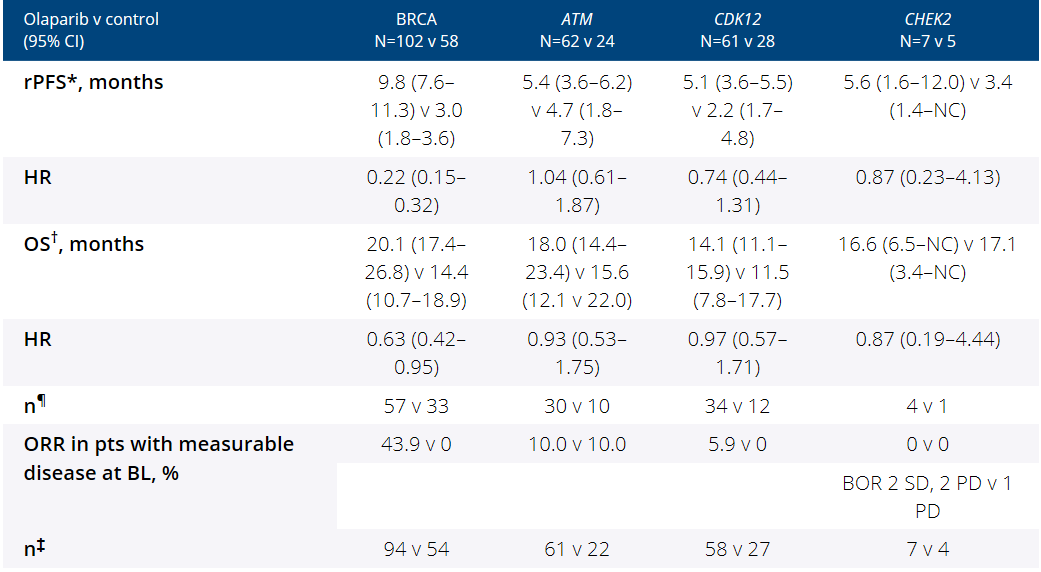
▲
PROfound研究部分亚组数据(截图来源:参考资料[3])
基于这项3期临床试验结果,2020年5月,奥拉帕利已获得FDA批准,用于治疗携带同源重组修复(HRR)基因突变的转移性去势抵抗性前列腺癌患者。
前列腺癌是男性中第二大常见癌症。mCRPC是一种严重的前列腺癌类型,患者的癌症已经扩散到身体的其它部位,而且即使体内雄激素已经被降到很低的水平,肿瘤仍然继续增殖。尽管针对mCRPC的男性可用的治疗方法有所增加,但五年生存率仍然很低。在mCRPC患者中,约20-30%会发生HRR基因突变。
祝贺阿斯利康奥拉帕利新适应症在中国获批,希望该批准能为更多前列腺癌患者带来新的治疗选择和获益。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局公告. Retrieved Jun 21,2021 from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210621084907105.html
[2]Lynparza approved in the US for HRR gene-mutated metastatic castration-resistant prostate cancer.Retrieved May 18, 2020, from https://www.astrazeneca.com/content/astraz/media-centre/press-releases/2020/lynparza-approved-in-the-us-for-hrr-gene-mutated-metastatic-castration-resistant-prostate-cancer.html
[3]Exploratory gene-by-gene analysis of olaparib in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC): PROfound. from https://meetinglibrary.asco.org/record/195127/abstract
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。









 个人中心
个人中心
 我是园区
我是园区




