宿主细胞残留DNA是生物制品生产过程中涉及的工艺相关杂质,它不仅会降低生物药的有效性,还可能带来传染性或致瘤性等安全问题。因此,各国的监管机构都对生物制品中残余DNA的含量进行了限制。
WHO和美国FDA现行指导方针推荐成品中残留DNA不高于10 ng/剂,美国FDA还指出生物制品宿主细胞残留DNA不高于100 pg/剂。欧洲药典通则规定生物制品残留DNA限度不超过10 ng/剂,但对个别疫苗的残留DNA限定标准更严格,如甲型肝炎灭活疫苗中的DNA残留量不得超过100 pg/剂,乙型肝炎疫苗中的DNA残留量不得超过10 pg/剂。中国药典2020年版三部规定,以细胞基质生产的生物制剂DNA残留量不能超过100 pg/剂,以细菌或真菌基质生产的疫苗DNA残留量不能超过10 ng/剂。
此外,对于外源性DNA残留量测定的方法,各国药典也给出了指导建议。美国药典2017年版USP40-NF35通则1130介绍了3种外源性DNA残留量测定的方法,分别为DNA探针杂交法、阈值法和实时定量PCR法。欧洲药典提出了实时定量PCR和免疫酶法,这两种定量宿主细胞残留DNA的灵敏分析方法。中国药典2020年版三部通则3407也规定,宿主细胞DNA残留量检测方法为DNA探针杂交法、荧光染色法和定量PCR法。
其中,qPCR法具有极高的灵敏度、序列特异性和准确性,可为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段,现已成为各生物制品厂家首选检测方法。
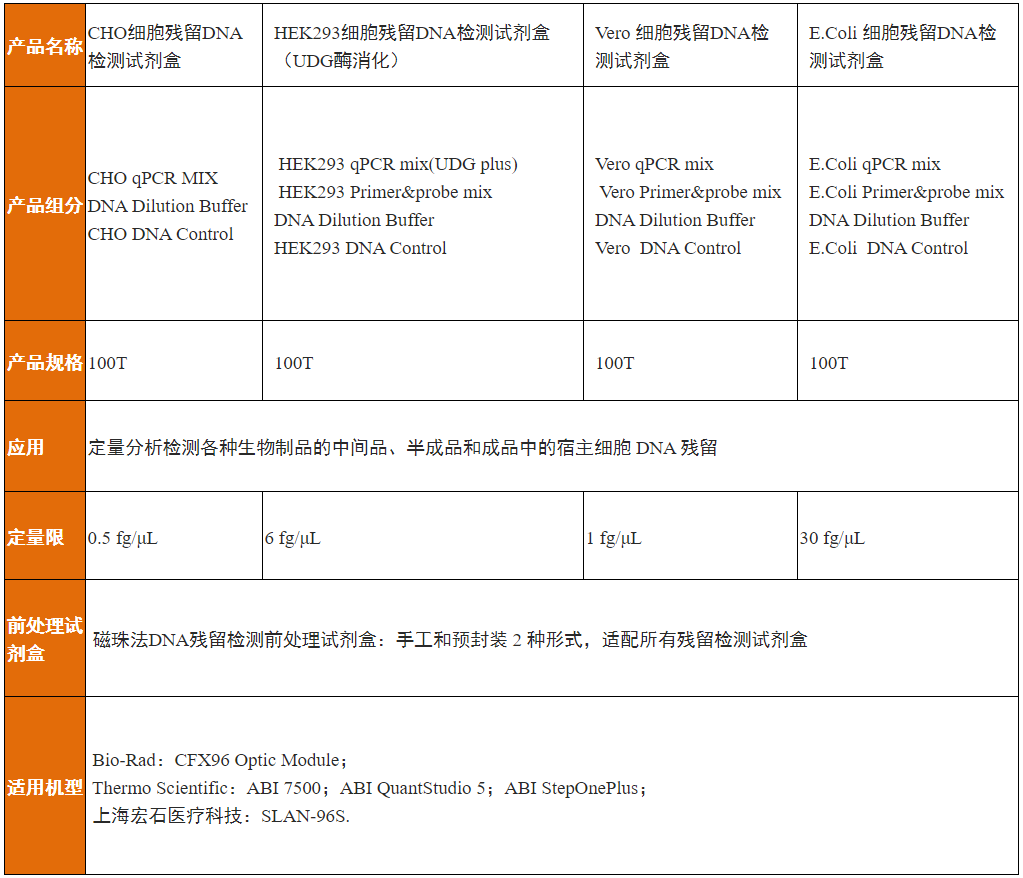
翌圣生物自主研发的CHO&HEK293&Vero&E.coli共4款宿主细胞残留DNA的qPCR法检测试剂盒,可快速高效检测生物药中宿主DNA残留量。


灵敏度高:检测下限可低至0.5fg/μL
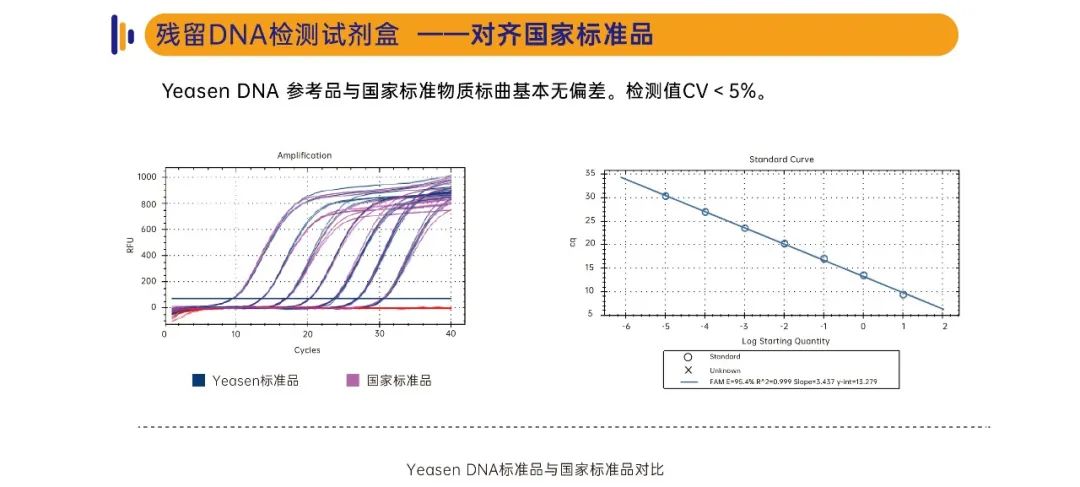
准确性高:DNA参考品与国家标准物质标曲基本无偏差,检测值CV<5%
精密度高:重复性CV值<10%,好于行业标准(15%),中间精密度<15%
专属性强:不同细胞系间无交叉反应
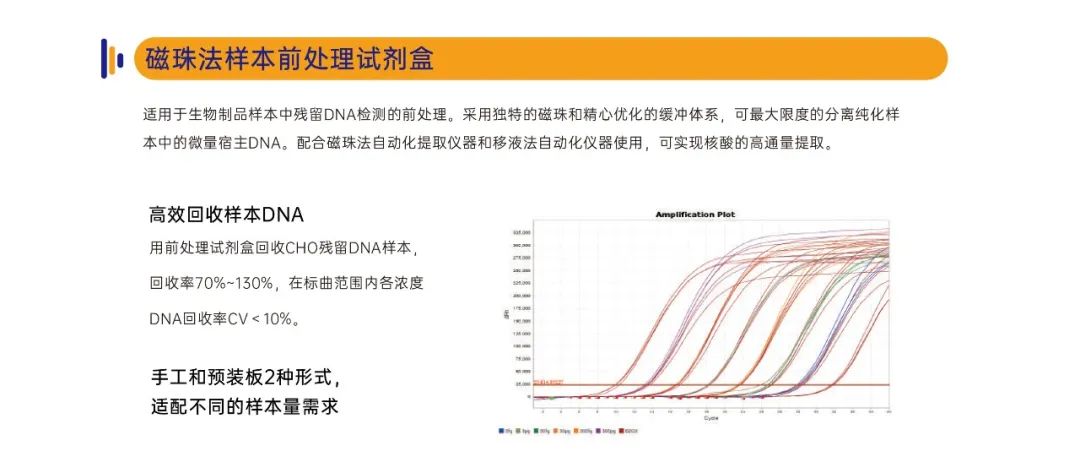
定量准确:配套专属磁珠法样本前处理试剂盒
操作时间短:3小时内完成全部检测流程
稳定性好:多次反复冻融扩增效率仍较高,-20℃可储存2年
耐用性强:DNA碎片化程度不影响检测结果,碎片化DNA回收率高,适配多款qPCR仪器







请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




