 前言
前言
2023年4月4日, 国家食品药品监督管理总局药品审评中心正式受理了河北森朗生物科技有限公司SENL101自体T细胞注射液用于治疗复发或难治性CD7+的T淋巴细胞白血病/淋巴瘤的临床试验申请,受理号:CXSL2300225。

01
CD7 CAR-T免疫疗法
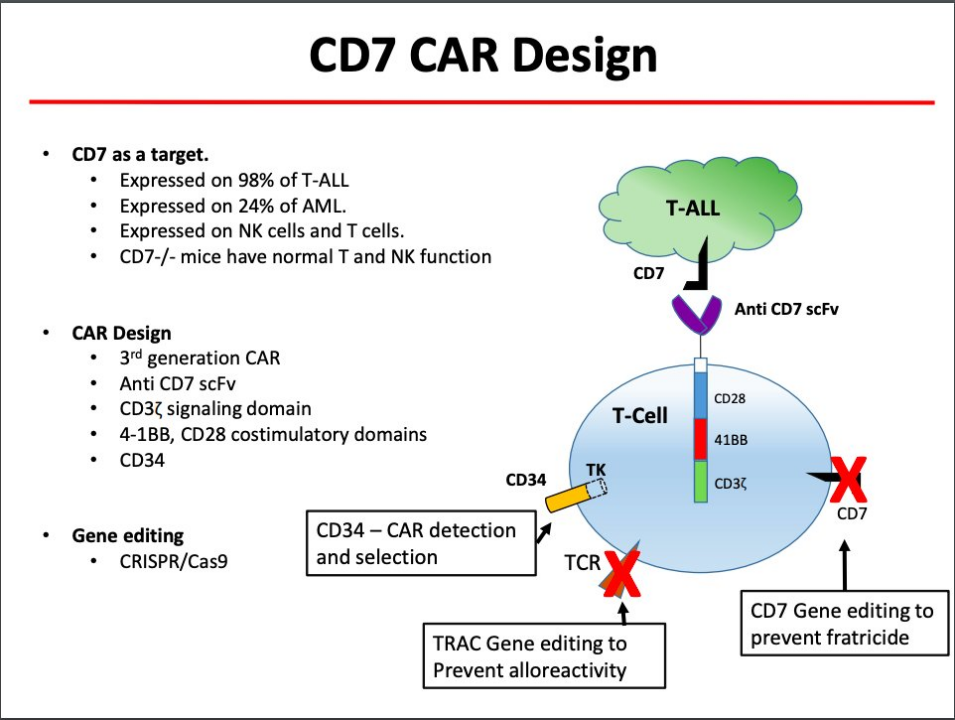
CD7是T细胞表面的高特异性靶点,在95% T淋巴细胞白血病(T-ALL)病例以及T和NK细胞谱系中表达,与大多数T细胞血液肿瘤相关,是潜在的CAR-T治疗靶点。CD7 CAR-T 是针对 T 系血液肿瘤的免疫治疗。
02
CD7 CAR-T的研发难点
a.CD7在T淋巴细胞的表达率约为95%,特定的靶点也存在于CAR-T细胞当中,因此CAR-T会出现自相残杀的现象,即CAR-T细胞基本上无法区分免疫细胞和肿瘤细胞;
b.以T细胞为靶细胞的CAR-T疗法,CAR-T细胞攻击CD7阳性(CD7+)正常T淋巴细胞,患者免疫系统也会遭受一定的损伤。大量清除T细胞后可能使患者出现严重相关的T细胞免疫缺陷,从而导致感染的风险增加。
03
CD7 CAR-T在研疗法
目前有许多CD7 CAR-T临床试验正在进行当中,表1显示部分在研的CD7 CAR-T疗法。

3.1 NS7CAR
NS7CAR疗法是由河北森朗生物科技公司等技术人员开发的一款无需额外CD7基因编辑或蛋白质表达阻断的“自然选择(Naturally Selected)”CD7 CAR-T细胞的新产品(图2)[2]。
2022年5月,他们在Blood杂志上发表了在T-ALL/LBL患者的1期临床试验(NCT04572308)结果,首次探索了NS7CAR疗法在人体内的安全性和有效性。
NS7CAR的首次人体临床试验表明,无需额外的基因编辑即可防止CD7表达,并成功生产NS7CAR-T细胞。总体而言,NS7CAR对治疗R/R T-ALL/LBL是安全且高效的。进一步评估NS7CAR-T 细胞疗法需要纳入更多患者并延长观察周期。

3.2 PA3-17注射液
PA3-17注射液是由博生吉医药自主研发的国际首款基于纳米抗体的CD7-CAR-T细胞注射液,2021年8月6日,该公司宣布其获得NMPA的临床试验默示许可,适应症为成人复发/难治性CD7阳性血液淋巴系统恶性肿瘤患者(18-70岁,包括界值)。
博生吉研制成功的自体CD7-CAR-T细胞,由于避免了基因编辑的相关风险、再加上体内呈现优越的扩增与持续性,因此疗效显著,安全性较高。
2022年4月19日,该公司宣布其PA3-17注射液I期临床试验首例受试者在郑州大学第一附属医院顺利完成回输。PA3-17注射液同步在美国也开展临床试验,获得了美国FDA孤儿药资格认定。
相关研究数据发表在Clinical Cancer Research杂志,PA3-17的长期患者随访结果表示:CAR-T细胞在8例患者体内均产生了有效扩增,在回输12天左右, CAR-T细胞在体内扩增达到峰值,甚至在回输后的270天依然能够在患者体内检测到CAR-T细胞的存在,证实了PA3-17注射液在体内的良好持久性。所有8例患者均对PA3-17注射液的单次输注耐受良好,且未观察到神经毒性事件。
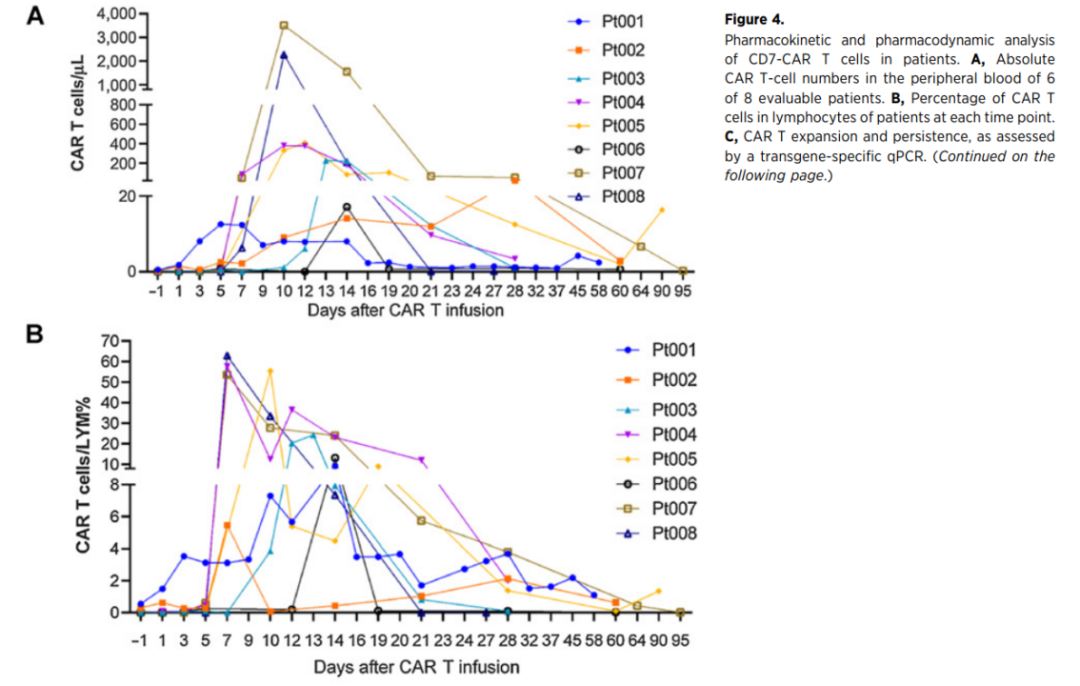
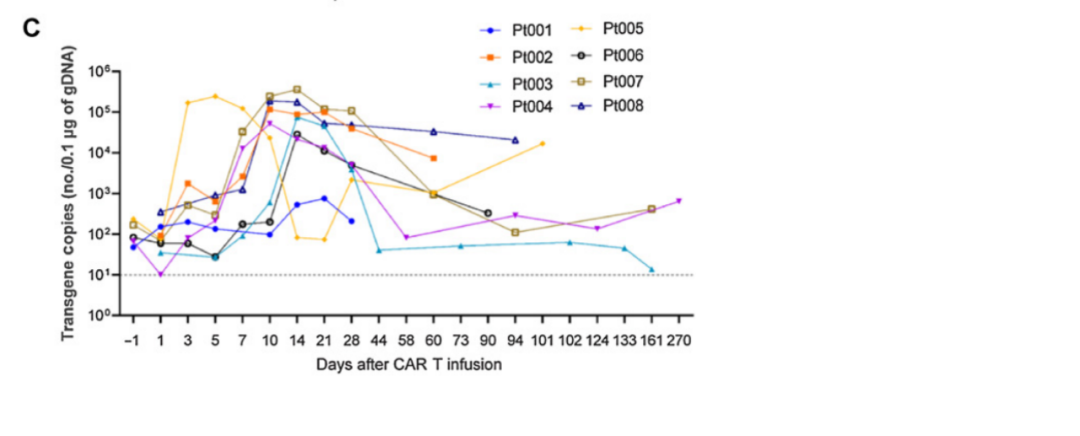 图注:CD7-CAR T细胞在患者中的药代动力学和药效学分析。
图注:CD7-CAR T细胞在患者中的药代动力学和药效学分析。
3.3 GC027
GC027是由亘喜生物基于TruUCAR平台开发一款用于人体试验、靶向CD7的通用型同种异体CAR-T单药疗法,主要用于治疗T-ALL。
临床前数据表明GC027具有优越的体外杀伤癌细胞的能力,同时在体内移植和抗白血病方面具有一定优势。在2021年的AACR年会上,亘喜生物公布了GC027的相关IIT数据,全部6名(100%)受试者均达到完全缓解,包括血细胞数量完全或未完全恢复(CR/CRi)。且未观察到神经毒性事件(ICANS)或急性移植物抗宿主病(aGvHD)的发生。

3.4 RD13-01
2022年9月24日,浙江大学医学中心血液与免疫疾病领域首席科学家、浙江大学医学院附属第一医院黄河教授团队在《Cell Research》报道靶向CD7通用型CAR-T细胞RD13-01治疗复发/难治性CD7阳性血液系统恶性肿瘤的I期临床研究最新研究成果[3]。该研究展示了CAR-T细胞疗法在T系血液肿瘤治疗方面的新突破。
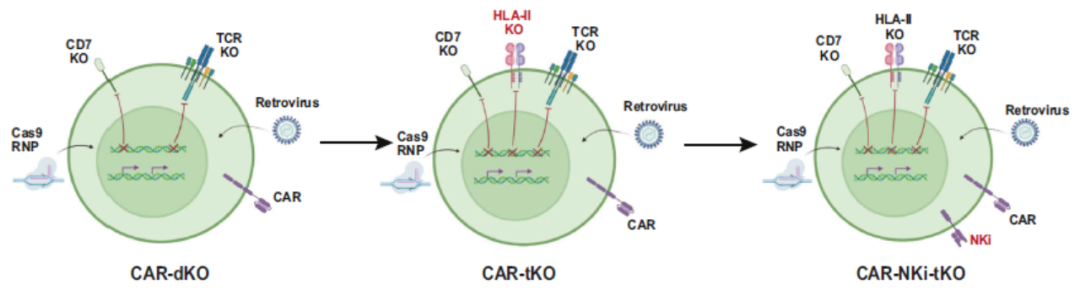
图3. CAR-T细胞从“CAR-dKO”到“CAR-tKO”再到“CAR-NKi-tKO”的发育图示。
RD13-01细胞治疗T系血液肿瘤不仅表现出优越的安全性和显著的疗效,同时体现了通用型CAR-T细胞对这类进展迅速的恶性肿瘤患者的适用性(图4)。RD13-01产品输注等待时间短(入组到输注的等待时间≤7天),无患者在等待输注过程中因疾病进展、制备失败等原因而无法接受输注。

3.5 BEAM-201
BEAM-201是Beam Therapeutics开发的基于胞嘧啶碱基编辑的针对CD7靶点的碱基编辑CAR-T细胞疗法,是首个同时针对4个基因展开编辑的CAR-T疗法。于2022年6月向FDA提交了治疗复发或难治性T-ALL(急性T淋巴细胞白血病)和其他CD7阳性恶性肿瘤的IND申请。
然而,在2022年8月,Beam Therapeutics宣布FDA临床搁置BEAM-201 IND申请(图5)。

总结与展望
由于CD7 CAR-T疗法会出现自相残杀的现象,以及攻击患者免疫系统两大开发难点,目前还没有CD7 CAR-T疗法被批准上市。
目前有许多CD7 CAR-T临床试验正在进行当中,包括通用型靶向CD7 CAR-T疗法RD13-01和无需额外CD7基因编辑或蛋白质表达阻断的“自然选择(Naturally Selected)”CD7 CAR-T细胞的新产品NS7CAR等。大部分都在临床早期,批准上市还需要一段路要走。
References
1.Phaik Ju Teoh and Wee Joo Chng, CAR T-cell therapy in multiple myeloma: more room for improvement, Blood Cancer Journal (2021) 11:84.
2.Peihua Lu, Ying Liu, Junfang Yang, Xian Zhang, Xiao Yang, Hui Wang, Lin Wang, Qinglong Wang, David Jin, Jianqiang Li, Xiaojun Huang, Naturally selected CD7 CAR-T therapy without genetic manipulations for T-ALL/LBL: first-in-human phase 1 clinical trial, Blood. 2022 Jul 28;140(4):321-334.
3.Yongxian Hu, Yali Zhou, Mingming Zhang, et.al, Genetically modified CD7-targeting allogeneic CAR-T cell therapy with enhanced efficacy for relapsed/refractory CD7-positive hematological malignancies: a phase I clinical study, Cell Research volume 32, pages 995–1007 (2022).
4.LB147 - Updates on clinical safety and efficacy result of GC027, the first-in-human, “Off-the-Shelf” CD7 CAR-T stand-alone therapy for adult patients with relapsed/refractory T-cell lymphoblastic leukemia (r/r T-ALL)
5.Autologous Nanobody-Derived Fratricide-Resistant CD7-CAR T-cell Therapy for Patients with Relapsed and Refractory T-cell Acute Lymphoblastic Leukemia/Lymphoma
识别微信二维码,添加生物制品圈小编,符合条件者即可加入
生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




