Caribou Biosciences提交1亿美元初步招股书,IPO前持股>5%的机构如下:

截止IPO前共融资约1.5亿美元,机构投资者包括Adage Capital,Anterra F&A Ventures, Avego Bioscience Capital, Avidity Partners, Invus, Farallon Capital, F-Prime Capital,Heritage Medical Systems, Janus Henderson Investors, LifeSci Venture,Maverick funds, Mission Bay Capital, Monashee Investment, PFM Health Sciences, Point72, Ridgeback Capital,Pontifax Global Food and Agriculture Technology Fund和Tekla Capital。战略合作投资者包括艾伯维(AbbVie Venture)、诺华(Novartis)等。
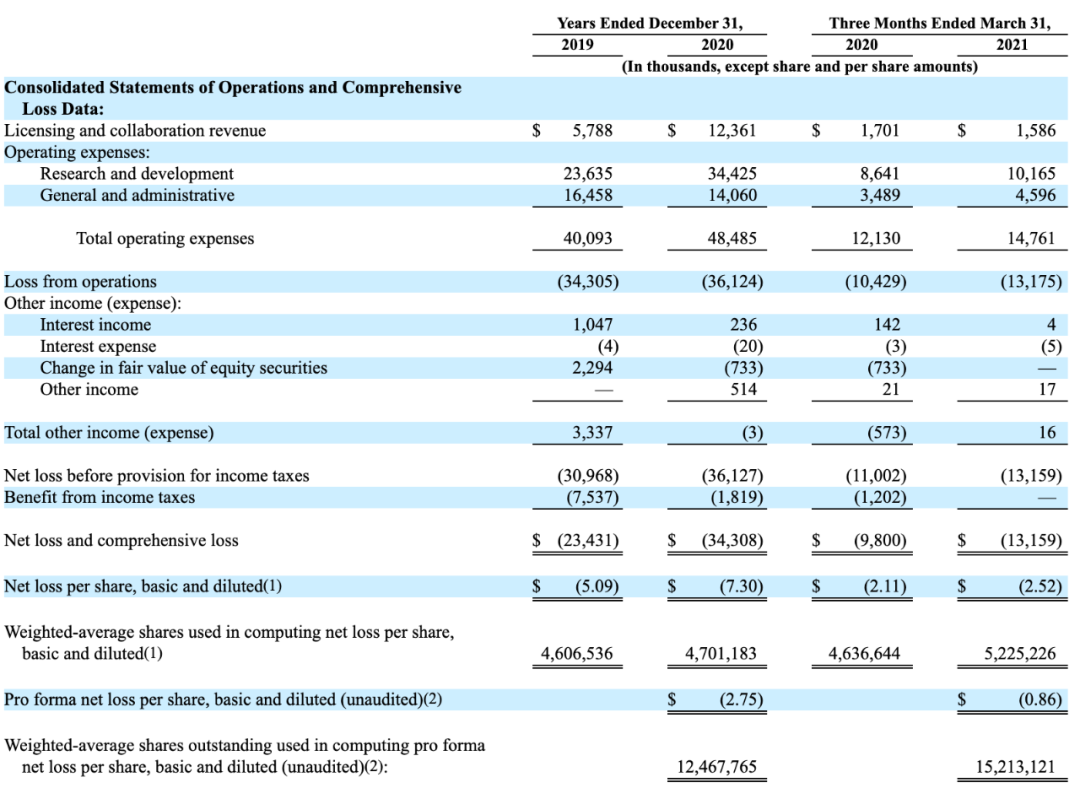
成立至今共收到1.61亿美元的对外授权、专利转让、服务协议等收入,其中包括出售Intellia Therapeutics普通股获得的8860万美元(CRISPR-Cas9技术许可协议所获普通股),和从艾伯维获得的4000万美元合作预付款。

Caribou Biosciences是一家临床阶段生物医药公司,使用CRISPR杂交RNA-DNA(CRISPR hybrid RNA-DNA)技术,研发下一代基因编辑细胞疗法,包括现货型(off-the-shelf)CAR-T和CAR-NK。公司创始人之一是2020年因CRISPR/Cas9基因编辑技术获得诺贝尔化学奖的Jennifer Doudna。该公司起步于Jennifer Doudna在Berkeley的实验室,公司CEO Rachel Haurwitz是Doudna的第一个从事CRISPR研究的研究生。2011年,她们与James Berger 和 Martin Jinek 一起创办了该公司。
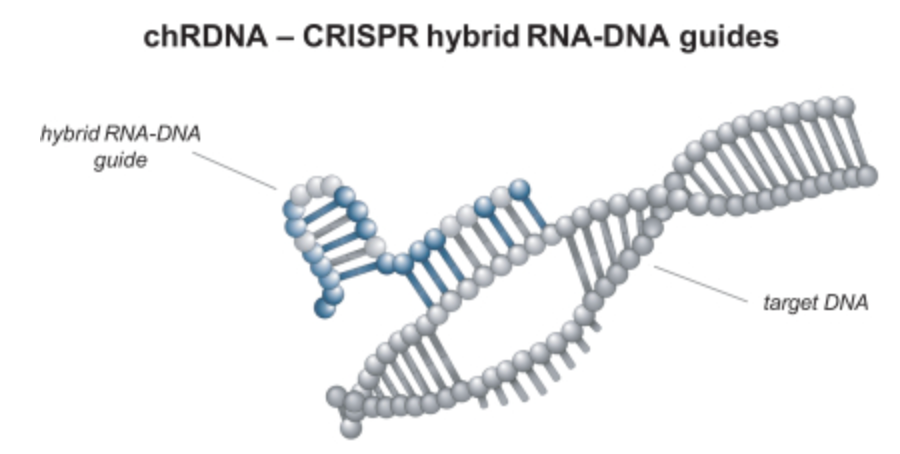
平台的专有chRDNA,使用杂交RNA-DNA分子(混合RNA和DNA核苷酸)引导Cas9/Cas12a进行DNA编辑(下图),使用杂交RNA-DNA分子的优势包括,1)编辑特异性更高,脱靶率更低;2)高效的目标基因敲除和插入,实现稳定的多重编辑,包括多个基因插入;3)可应用在多种细胞类型,chRDNA可与Cas9和Cas12a兼容;4)杂交RNA-DNA分子可通过简单化学合成得到。
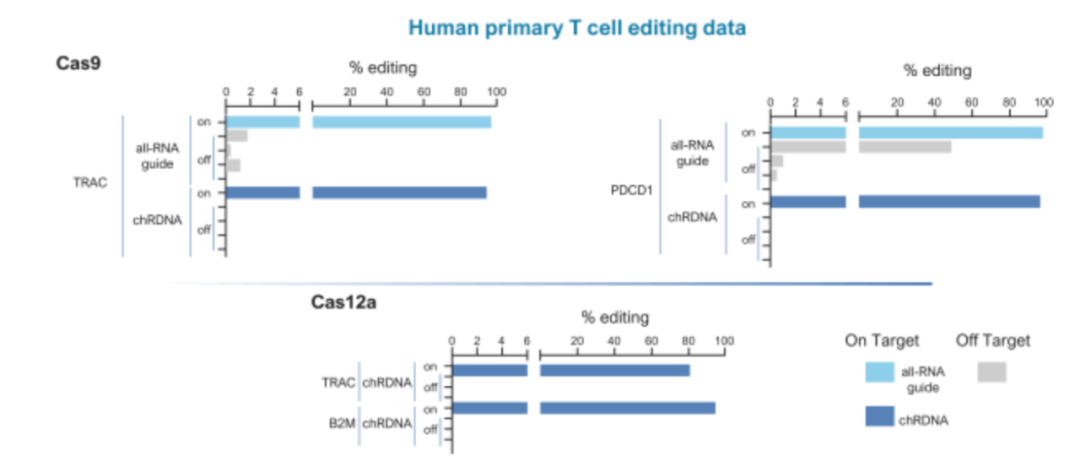
Caribou Bio希望通过chRDNA扩宽同种异体细胞疗法的应用范围,包括敲除细胞表面PD-1,提高CAR-T细胞持久性,降低排异;保持基因组完整性的同时进行多次编辑;对iPSC(多能诱导干细胞)进行基因编辑,生成iNK细胞治疗实体瘤。
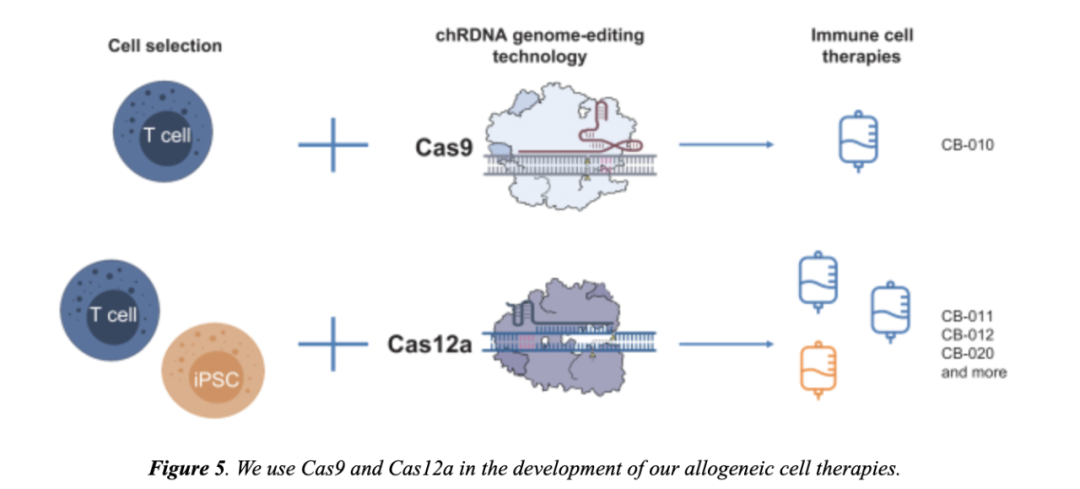
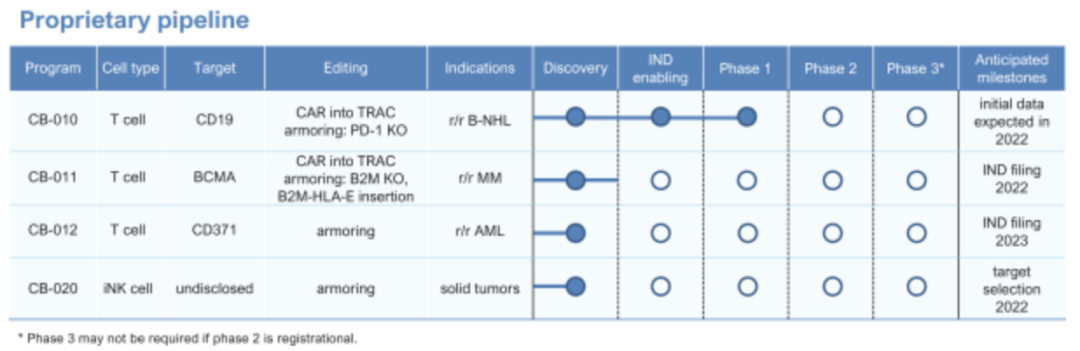
其主要在研管线CB-010是同种异体、靶向CD19的CAR-T细胞疗法,使用Cas9 chRDNA进行3个编辑,包括TRAC基因敲除,AAV6转导和同源定向修复将CD19-CAR插入到TRAC基因中,使CD19 CAR位点整合到T细胞基因组的同时,消除TCR表达以降低移植物抗宿主病的风险。以及把编码PD-1蛋白的基因敲除,提高T细胞抗肿瘤持久性。
目前在复发/难治性B细胞非霍奇金淋巴瘤中进行临床1期研究ANTLER(NCT04637763),预计2022年有初步数据。
其他管线包括CB-011和CB-012,前者靶向BCMA治疗复发/难治性多发性骨髓瘤,并通过基因编辑达到“免疫隐形”效果,避开免疫系统,该管线预计明年IND。CB-012则靶向CD371,指征急性髓系白血病。
此外在2021 年 2 月,公司与AbbVie达成合作,为AbbVie开发两种新的 CAR-T 细胞疗法,预付款4000万美元,未来里程碑付款约3亿美元。
现金、现金等价物:145M (As of March 31, 2021)



 个人中心
个人中心
 我是园区
我是园区




