
单细胞ATAC 测序 (scATAC-seq)已经开始作为一种强有力的工具来测量染色体可及性(chromatin accessibility)图谱,进而从单细胞水平上研究转录因子在调控启动子、增强子、激活子等所扮演的角色。由于第一代scATAC-seq通量低、数据质量差等局限, 微滴基于的scATAC-seq (如 10X Genomics和dscATAC-seq 【1】)被开发出来,从而使得高质量、高通量的scATAC-seq成为可能。虽然微滴基于的scATAC-seq能够一次对数千个单细胞进行测序,但是要对大量样本的测序时 (如: 药物筛选、多病人群体、多时间点、多空间区域位置等),仍然非常困难且价格高昂。dscATAC-seq能够通过组合标记(combinatorial indexing)的方法进行多样品同时测序,但是需要定制大量带有标记的Tn5 转座子,耗时长且质控难。
现今,虽然多种不同的方法被开发出来实现多样本单细胞RNA (scRNA-seq)同时测序,但是针对多重样品单细胞scATAC-seq的方法却非常有限,并且还没有有效的方法用来实现多样品单细胞多组学同时测序(比如10X Genomics scATAC&RNA-seq)。更麻烦的是,实现多样品scRNA-seq的方法也并非简单和容易,比如CellHashing 【2】通过使用通用抗体实现多样品标记、MULTI-seq【3】需要合成特定脂修饰的核酸序列等。而且这些方法都需要对细胞进行预先的标记处理,增加了额外的工作量。
2021年10月19日,MD安德森癌症研究中心的Nicholas Navin教授课题组在Molecular Cell发表了封面文章Simple oligonucleotide-based multiplexing of single-cell chromatin accessibility,报道了一种只用未经任何特殊修饰的核苷酸序列就能实现多样品scATAC-seq同时测序的方法: SNuBar-ATAC。该方法巧妙地利用了Tn5转座酶作为运送样品标签序列的载体,在进行Tagmentation 反应的同时便将不同的样品进行了标记。标记好的样品混合后,即可进行载入微流控系统进行scATAC-seq文库构建。测序后通过识别每个细胞中的样品标签,即可获知每个细胞的样品来源。


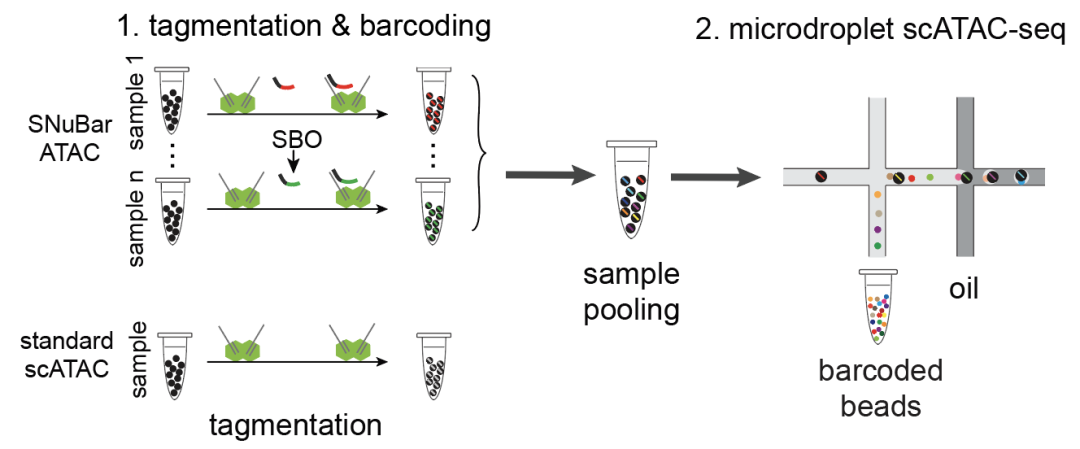
作者首先用SNuBar-ATAC标记两个来自于不同物种的细胞系(K562和A20),经混合后进行scATAC-seq文库构建来验证SNuBar-ATAC的准确性,测序发现SNuBar能够正确标记和识别99%的细胞。随后作者又用SNuBar标记了96个不同的样品,发现这些被标记的样品都能被正确识别和鉴定,证明了该方法的不但准确而且高通量。使大量样本同时进行有效标记并进行scATAC-seq测序成为可能。
随后作者用SNuBar-ATAC标记了28只经不同治疗方案组合(放疗、化疗、免疫治疗和靶向治疗)治疗的患肺癌的小鼠,产生了每只小鼠的ATAC图谱。作者发现与对照组相比,在经4Gy+PDL1+Tala治疗的小鼠中,抑癌基因的ATAC信号增强,肿瘤免疫相关信号通路显著下调;同时,在经Chemo+2Gy+Tala治疗的小鼠中,抑癌基因的ATAC信号增强,DNA修复相关信号通路显著激活。
除了展示上述多样品标记实验,作者还用SNuBar标记了人正常乳腺组织中32个不同的空间区域,并描绘了表观遗传的空间特异性。作者发现不但不同细胞类型的染色体可及性在空间上分布是有空间特异性的,相同细胞类型的不同细胞状态也存在空间分布特异性,这些空间特异性是跟细胞所处的微环境息息相关的。
除了scATAC-seq外,scATAC&RNA-seq多组学测序方法也被开发出来并开始被广泛应用。作者发现SNuBar不仅能同时标记多样本进行scATAC-seq测序文库构建,而且也能同时标记多重样本进行scATAC&RNA-seq多组学文库构建(SNuBar-ARC)。类似于SNuBar-ATAC,作者也用不同的细胞系混合实验对方法准确性及有效性进行了评估。随后,作者用SNuBar-ARC标记了四个来自于不同个体的乳腺组织并进行了scATAC&RNA-seq测序,作者鉴定了正常乳腺组织中的细胞类型,并鉴定了一批与细胞类型特异的转录调控因子。
总的来说,该文章报道了一种仅利用简单核苷酸序列就可实现简单高效的多样本标记方法,用来实现多样本大规模scATAC-seq或者scATAC&RNA-seq测序。随着基于微滴的单细胞测序通量提高,作者相信SNuBar会发挥越来越大的作用,为人类细胞图谱(HCA)和人类癌症图谱网路(HTAN)等大规模单细胞测序计划贡献一份力量。
MD安德森癌症研究中心的instructor王开乐,博士后肖珍娜和博士研究生严云是本研究的共同第一作者,第二作者叶睿及实验室其他人员也对本研究作出了巨大贡献。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00795-4
参考文献
[1] C.A. Lareau, F.M. Duarte, J.G. Chew, V.K. Kartha, Z.D. Burkett, A.S. Kohlway, D. Pokholok, M.J. Aryee, F.J. Steemers, R. Lebofsky, J.D. Buenrostro. Droplet-based combinatorial indexing for massive-scale single-cell chromatin accessibility. Nat. Biotechnol., 37 (2019), pp. 916-924
[2] M. Stoeckius, S. Zheng, B. Houck-Loomis, S. Hao, B.Z. Yeung, W.M. Mauck 3rd, P. Smibert, R. Satija. Cell Hashing with barcoded antibodies enables multiplexing and doublet detection for single cell genomics. Genome Biol., 19 (2018), p. 224
[3] C.S. McGinnis, D.M. Patterson, J. Winkler, D.N. Conrad, M.Y. Hein, V. Srivastava, J.L. Hu, L.M. Murrow, J.S. Weissman, Z. Werb, et al. MULTI-seq: sample multiplexing for single-cell RNA sequencing using lipid-tagged indices. Nat. Methods, 16 (2019), pp. 619-626
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




