▎药明康德内容团队报道
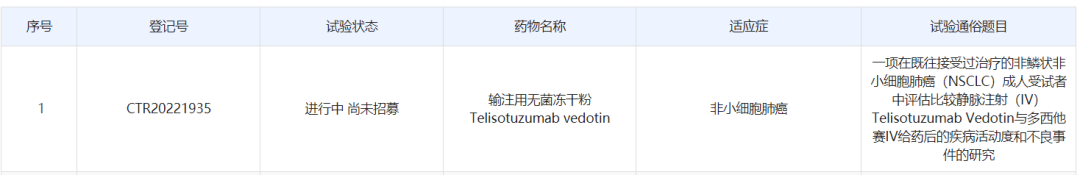
中国药物临床试验登记与信息公示平台显示,艾伯维(AbbVie)已启动一项国际多中心(含中国)3期临床试验,以评估telisotuzumab vedotin(ABBV-399)在既往接受过治疗的非鳞状非小细胞肺癌患者中的疗效和安全性。公开资料显示,ABBV-399是一款在研的靶向c-Met的抗体偶联药物(ADC)。该药已获得美国FDA授予的突破性疗法认定,用于治疗非小细胞肺癌。

非小细胞肺癌(NSCLC)是最常见的肺癌种类,大约占肺癌患者总数的85%。MET是癌症的驱动基因之一。在NSCLC中,带有MET突变的病例约占总数的3%~4%。这些患者一般年龄较大,预后往往较差。而且,MET信号通路在驱动肺癌对其它靶向疗法产生耐药性方面也具有重要作用。
ABBV-399是艾伯维管线中研发进展最快的ADC项目,目前已进入3期临床研究阶段
。该药物靶向c-Met(MET基因编码的蛋白),以微管蛋白抑制剂MMAE作为毒性有效载荷。2022年1月,FDA授予ABBV-399突破性疗法认定,用于治疗在铂类药物治疗期间或治疗后发生疾病进展的c-Met过表达的晚期/转移性EGFR野生型非鳞状NSCLC患者。
根据中国药物临床试验登记与信息公示平台,艾伯维本次登记的是一项随机、开放、国际多中心3期临床试验,旨在比较ABBV-399与多西他赛在既往接受过治疗的c-Met过表达、EGFR野生型局部晚期/转移性NSCLC患者中的疗效和安全性。该研究将在148家临床试验机构开展,其中包括40家中国临床试验机构。试验计划在国际入组698例患者,中国境内入组105例患者。
这项3期临床试验的主要目的是:确定与多西他赛治疗相比,ABBV-399是否能够改善患者的无疾病进展生存期(PFS,根据ICR评估)和/或总生存期(OS)。研究的次要目的是确定患者的总缓解率(ORR)、缓解持续时间(DoR)、根据研究者评估的PFS等等。
值得一提的是,ABBV-399的治疗效果已在临床试验中得到初步验证。根据在c-Met过表达NSCLC患者中开展的一项2期临床试验中期分析数据,在EGFR野生型非鳞状NSCLC患者中,c-Met高表达组的ORR为53.8%,c-Met表达水平中等组的ORR为25.0%。也正是基于这一数据,FDA授予了该药突破性疗法认定。
参考资料:
[1] 中国药物临床试验登记与信息公示平台.Retrieved Aug 03,2022, from http://www.chinadrugtrials.org.cn/index.html
[2] AbbVie Announces U.S. FDA Granted Breakthrough Therapy Designation (BTD) to Telisotuzumab Vedotin (Teliso-V) for Previously Treated Non-Small Cell Lung Cancer. Retrieved January 4, 2022, from https://news.abbvie.com/news/press-releases/abbvie-announces-us-fda-granted-breakthrough-therapy-designation-btd-to-telisotuzumab-vedotin-teliso-v-for-previously-treated-non-small-cell-lung-cancer.htm
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




