
随着社会的发展和生活水平的提高,肥胖和II型糖尿病逐渐发展为全球性的健康问题【1】。但肥胖和II型糖尿病的发病具有很大的异质性,基因、环境等都被认为是发病的重要因素【2】。白色脂肪组织是能量储存的重要器官,可以将体内多余的能量以脂肪的形式储存起来。与褐色脂肪不同,白色脂肪含有极少量的线粒体,从而保持低呼吸速率,抑制自身能量损耗【3】。生理状态下,只有在极度饥饿或高能量需求刺激时,白色脂肪组织储存的脂肪才被释放出来【4】。古代人摄取食物相对困难,能量存储大大提高了存活优势。但是作为能量储存器官,白色脂肪组织的增生和肥大具有一定的限度。现代生活及饮食方式的改变,导致能量极易过度摄入,超出白色脂肪组织的负荷限度,从而导致脂肪组织病变并将过载脂质释放到外周,引起脂毒性与代谢综合症【5】。由于能量过载是发展为肥胖和II型糖尿病的一大驱动力,目前很多研究聚焦于宏量营养元素,如膳食中的糖、脂肪、蛋白质等在肥胖和II型糖尿病发生和发展中的作用【6】。很少研究关注于微量元素对肥胖和糖尿病的影响。
2021年6月25日,德克萨斯大学西南医学中心Philipp Scherer教授研究团队在Cell Metabolism 上发表题为 Adipocyte iron levels impinge on a fat-gut crosstalk to regulate intestinal lipid absorption and mediate protection from obesity 文章。研究发现,在高脂饮食诱状态下,降低白色脂肪组织中的铁含量可以抑制肠道对脂肪的吸收,从而可以预防和治疗肥胖及胰岛素抵抗的发生。

铁是线粒体呼吸链辅酶的重要组成部分,已有研究报道铁对褐色脂肪组织的生热具有不可或缺的作用【7】。该研究发现铁在不同种类的脂肪组织、以及不同的发育、分化状态下对铁的需求差异很大。与褐色和米色脂肪组织不同,白色脂肪组织对铁的需求量极低,脂肪前体细胞中的铁含量足以满足白色脂肪组织在发育以及分化过程中的铁需求。
在高脂饮食诱导状态下,降低白色脂肪组织的铁含量不仅可以降低脂质过氧化、降低血脂、降低氧化压力和炎症、降低脂肪组织的增生,胰岛素抵抗和脂肪肝也都明显得到改善。在常温和30度恒温条件下,低铁含量的白色脂肪组织都远比对照组健康,小鼠也更加苗条和健康。进一步研究发现,白色脂肪组织与肠道脂肪吸收存在交互作用。降低白色脂肪组织铁含量影响了肠道脂肪吸收过程中的膜泡运输,从而抑制过多能量吸收。通过脂肪移植与体外小肠类器官与脂肪组织共培养,研究人员发现调控信号来源于白色脂肪组织。通过腺病毒相关病毒介导的白色脂肪组织铁外排蛋白过表达,研究人员发现,在高脂饮食诱导的肥胖小鼠中,降低白色脂肪铁含量可以逆转肥胖表型,提高胰岛素敏感性。
综上所述,该研究首次揭示了白色脂肪组织对肠道脂吸收存在调控作用。降低白色脂肪铁含量,能够使白色脂肪组织更好地感受吸收与存储平衡,从而限制过多的脂肪吸收 (图1)。人体脂肪以白色脂肪为主,因此,研发靶向人体白色脂肪组织的转运系统,特异降低白色脂肪组织铁含量,将为临床上治疗肥胖及型糖尿病提供新的思路。
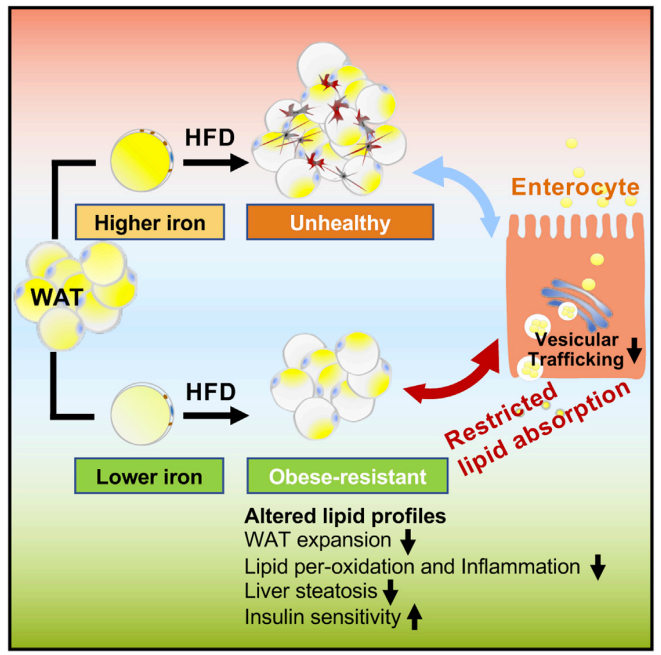
图1. 降低白色脂肪铁含量对肠道脂吸收及代谢的影响
德克萨斯大学西南医学中心糖尿病研究中心的张竹珍博士为本文的第一作者,Philipp Scherer教授为通讯作者。为本文做出重要贡献的还有西南医学中心的訾振振博士、赵善刚博士、朱庆章博士,安宇博士,邓迎峰教授。贝勒医学院的朱毅教授,以及天津医科大学的李娜博士。
原文链接:
https://doi.org/10.1016/j.cmet.2021.06.001
参考文献
1. Mokdad, A.H., et al., Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001. JAMA, 2003. 289(1): p. 76-9.
2. Ussar, S., et al., Interactions between Gut Microbiota, Host Genetics and Diet Modulate the Predisposition to Obesity and Metabolic Syndrome. Cell Metab, 2015. 22(3): p. 516-530.
3. Moreno-Navarrete, J.M., et al., Fine-tuned iron availability is essential to achieve optimal adipocyte differentiation and mitochondrial biogenesis. Diabetologia, 2014. 57(9): p. 1957-67.
4. Nielsen, T.S., et al., Dissecting adipose tissue lipolysis: molecular regulation and implications for metabolic disease. J Mol Endocrinol, 2014. 52(3): p. R199-222.
5. Rutkowski, J.M., J.H. Stern, and P.E. Scherer, The cell biology of fat expansion. J Cell Biol, 2015. 208(5): p. 501-12.
6. American Diabetes, A., et al., Nutrition recommendations and interventions for diabetes: a position statement of the American Diabetes Association. Diabetes Care, 2008. 31 Suppl 1: p. S61-78.
7. Li, J., et al., Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes. Adv Sci (Weinh), 2020. 7(12): p. 1903366.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




