
责编 | 兮
蛋白质是组成生命的物质基础,是生命活动的主要承担者,然而蛋白质在合成之后,往往需要经过一系列蛋白质翻译后修饰
(Protein post-translational modifications, PTMs)
,通过功能基团的添加或去除,调节蛋白质的生化性质从而改变其活性。常见的蛋白质翻译后修饰包括磷酸化、泛素化、甲基化、糖基化、棕榈酰化等。其中磷酸化修饰是目前已知分布最为广泛的PTM。蛋白质磷酸化的相关研究起步于20世纪初,直到近十年,每年平均仍有1.5万篇相关研究被报道。据估计,真核生物中有将近1/3的蛋白能够被磷酸化。人类蛋白质组中含有10多万个潜在的磷酸化位点。
相对于磷酸化修饰,蛋白的焦磷酸化修饰作为一种新发现的PTM,研究历史相对较短。焦磷酸化修饰最早被发现于糖原合成中。2007年,Solomon H. Snyder课题组第一次确定蛋白质上也存在焦磷酸化修饰
【1】
。目前认为蛋白焦磷酸化修饰主要分为两个步骤进行:(1)蛋白质的丝氨酸或者苏氨酸位点被激酶磷酸化修饰;(2)在磷酸化的基础上,IP7通过水解作用解离β-磷酸基团,同时释放大量的自由能促进β-磷酸基团通过Mg2+辅因子转移到靶蛋白的磷酸基上,最终形成蛋白焦磷酸化。由于目前没有蛋白质的焦磷酸化酶的相关报道,一般认为蛋白焦磷酸化属于无酶催化的修饰。
2023年1月4日,来自中山大学生命科学学院的崔隽教授课题组在Molecular cell杂志发表了题为
Metabolic enzyme UAP1 mediates IRF3 pyrophosphorylation to facilitate innate immune response
的论文,
发现焦磷酸化酶UAP1可以结合到转录因子IRF3上,直接正向调控I型干扰素反应,还发现UAP1作为第一个被发现的蛋白焦磷酸化酶,通过催化IRF3的焦磷酸化,增强机体固有免疫应答,降低病毒感染的新机制。
该研究首先通过功能筛选,发现敲除糖基化底物合成中关键的焦磷酸化酶UAP1能够明显抑制细胞的抗病毒活性,而过表达UAP1则会增强I型干扰素以及干扰素刺激基因的表达。为了进一步的研究,研究人员尝试构建Uap1敲除小鼠,发现Uap1敲除的小鼠纯合致死,提示UAP1在机体内有重要功能。幸运的是,他们发现Uap1杂合小鼠能够顺利成活,且细胞中UAP1的蛋白表达量降低一半以上,可以作为敲低小鼠使用,并发现Uap1敲低的小鼠对各种病毒的感染都更敏感,其抗病毒能力明显下降,揭示了其在机体抗病毒免疫中的重要作用。
为了探究UAP1调控抗病毒免疫的具体机制,研究人员通过免疫共沉淀实验发现UAP1可以特异性结合转录因子IRF3。UAP1的酶活突变体丧失了其促进I型干扰素通路激活的能力,表明UAP1的抗病毒功能依赖于其酶活性。研究人员进一步确定UAP1主要通过催化IRF3的焦磷酸化修饰,而不是糖基化修饰影响IRF3的活性。通过抑制剂实验,研究人员发现O-糖基化抑制剂
(OSMI-1)
或者N-糖基化抑制剂
(TM)
处理细胞不会影响UAP1对I型干扰素的促进作用,而焦磷酸化修饰抑制剂
(TNP)
处理会明显抑制UAP1的抗病毒功能。补回UAP1在己糖胺通路中的重要产物UDP-N-乙酰基葡萄糖胺,不能回复敲除UAP1对IRF3及其抗病毒免疫的调控作用,揭示了UAP1可能直接通过催化蛋白的焦磷酸化发挥功能。进一步的研究通过同位素示踪法、焦磷酸试剂盒检测以及质谱实验等不同实验方法,证明UAP1能够特异性催化IRF3的Ser386位点的焦磷酸化修饰。研究人员构建了Ser386位点失活的S386A突变体,发现S386点突变后IRF3不能进一步活化,IRF3 C端5ST活性位点
(Ser396)
也不能发生磷酸化,同时IRF3二聚化和入核能力也明显下降,这些结果表明UAP1介导的焦磷酸化修饰对抗病毒固有免疫的调控至关重要。
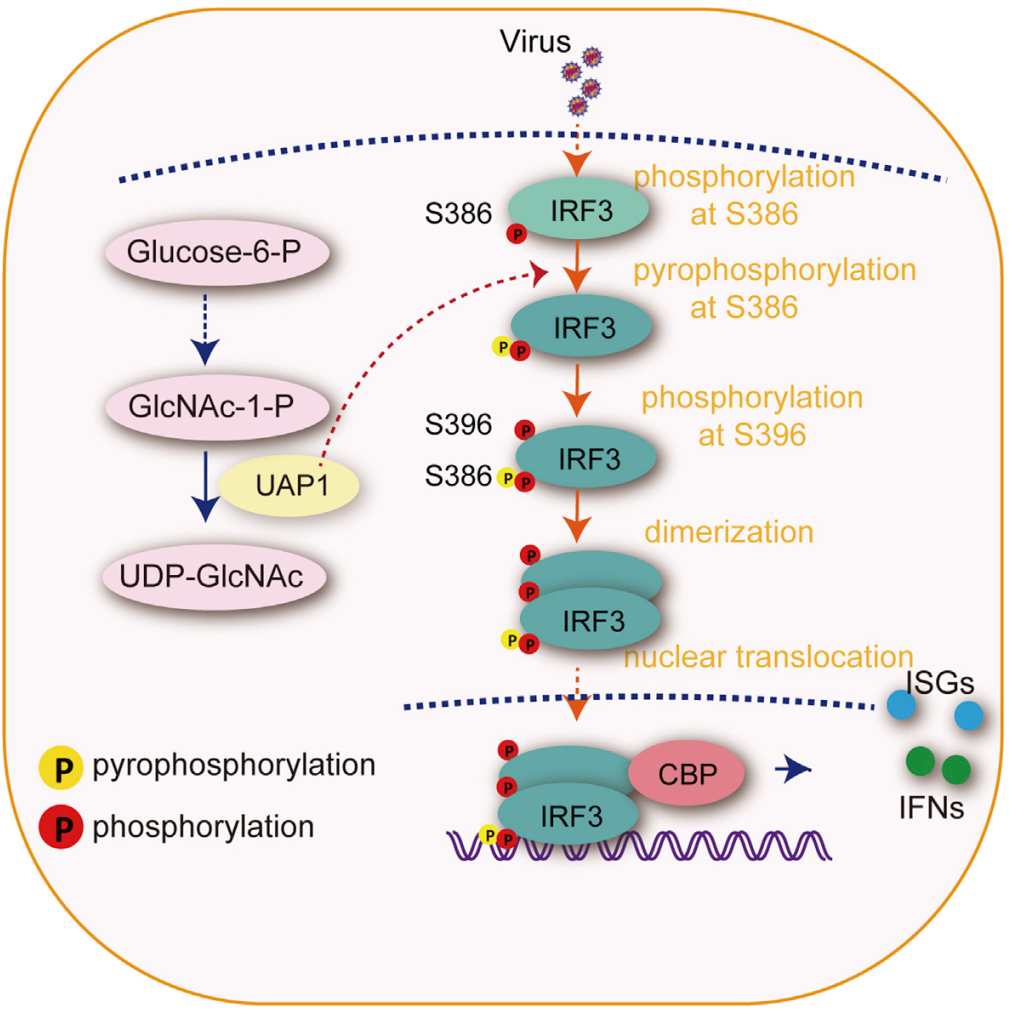
图 UAP1通过催化IRF3焦磷酸化,调控IRF3活性及I型干扰素信号通路的工作模型
该研究不仅揭示了UAP1作为焦磷酸化酶,通过催化IRF3的焦磷酸调控抗病毒信号通路的新机制,还提出了一个有趣的问题:蛋白焦磷酸化在细胞信号转导水平上到底有多普遍?由于焦磷酸化修饰是磷酸化修饰的延伸,以往关于磷酸化调控功能的研究,有多少实际上是通过焦磷酸化造成的呢?对于这些问题的后续研究可能在未来产生一些列突破。
中山大学生命科学学院的崔隽教授为该项工作的通讯作者。中山大学生命科学学院的杨帅博士为该研究论文的第一作者。
原文链接:
https://doi.org/10.1016/j.molcel.2022.12.007
制版人:十一
1. Bhandari R, Saiardi A, Ahmadibeni Y, Snowman AM, Resnick AC, Kristiansen TZ, Molina H, Pandey A, Werner JJ, Juluri KR, Xu Y, Prestwich GD, Parang K, Snyder SH. Protein pyrophosphorylation by inositol pyrophosphates is a posttranslational event. Proc Natl Acad Sci U S A 2007, 104(39): 15305-15310.
2. Saiardi A. Protein pyrophosphorylation: moving forward. BIOCHEM J 2016, 473(21): 3765-3768.

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。












 个人中心
个人中心
 我是园区
我是园区





