Supernus Pharma:明显低估的收入稳定且有丰富管线的CNS药物研发公司
收藏
关键词:
药研发药物药物研发
资讯来源:蹊之美股生物医药 + 订阅账号
发布时间:
2021-02-01
微信公众号:蹊之美股生物医药/CaesarBiotech
主要公司:Supernus Pharmaceuticals (NASDAQ: SUPN)

公司在2020年4月从USWM收购3个已上市CNS药物(APOKYN®, MYOBLOC® and XADAGO®),3个药物2019全年销售额为$150million,公司还有已上市抗癫痫/偏头痛药物2个(Trokendi XR and Oxtellar XR),销售额增长稳定;
公司最近披露的多动症管线SPN-812的3期临床数据在儿童、青少年和成人都有不错的结果,SPN-830阿扑吗啡和SPN-812虽然都收到过FDA的CRL,但都不是由于药物有效性和安全性的问题,最终批准也没问题,并有可能在2021年获得FDA批准并上市;
公司目前的市值$1.5B左右,有5个已上市药物,年销售额$500M,同时有2个完成3期临床试验并取得不错结果的管线,还有2-3个早期管线,对于有稳定收入和丰富管线的中枢神经系统药物研发公司,目前的市值非常吸引人,是2021年首选的公司,目标价格1年为$55/share以上;
风险:2个3期临床试验的批准再起波折,早期管线进展不顺利,已上市药物的专利期过期,但这个在估值中已计算进去。
1997年-2005年间,是作为Shire Plc在美国的子公司运营,作为一个独立的实体进行运营。2005年后,Supernus Pharmaceuticals从公司剥离出来并于2012年纳斯达克上市。公司主要专注于中枢神经系统疾病领域,目前已有5个已上市药物,2个后期临床试验管线,2-3个早期临床试验管线。公司主要是通过专有的formulation technologies 将已有药物重新成药,降低不良反应,或是为已有疗法开发新的适应症,关键技术平台包括:Microtrol,Solutrol和EnSoTrol。技术已被用于生产十种市场产品,包括:Trokendi XR和Oxtellar XR;为Shire开发的Adderall XR,Intuniv,Mydayis;为United Therapeutics Corporation 开发的Orenitram;以及公司自己的产品SPN-812。Microtrol多颗粒输送平台multiparticulate delivery platform,Solutrol基质输送平台(matrix delivery platform)
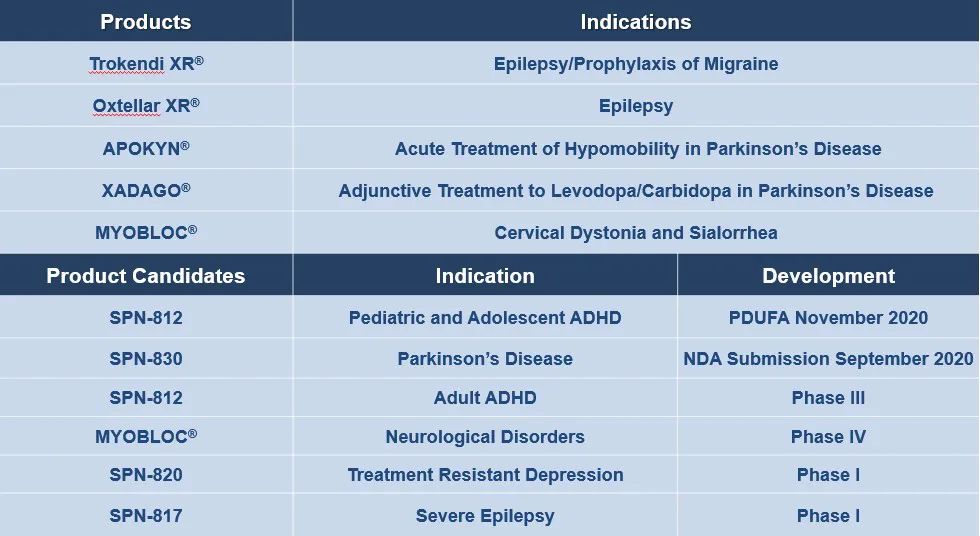
公司已上市产品共5个,集中在中枢神经治疗(CNS)领域,其中3个是2020年4月从US WorldMeds(USWM)收购获得,2个为公司自行研发的批准的药物(Trokendi XR and Oxtellar XR)。
1. 从USWM收购组合中已上市药物APOKYN®, MYOBLOC® and XADAGO®简介
收购USWM(US WorldMeds)产品组合费用为$530M,包括$300M预付款和$230M里程碑付款。产品组合包括APOKYN®(盐酸阿扑吗啡),MYOBLOC®(B型肉毒杆菌毒素),XADAGO(B型单胺氧化酶(MAO-B)抑制剂),这3款已上市产品2019年销售额为$150M。这三款药物市场上都有竞争的药物,从2020年的销售数据来看,增长还是稳定的。可能会有10%左右的增长,具体还要看4季度的销售数据加以确定。在收购USWM的CNS组合后,其相应的销售团队和销售咨询团队也一起加入公司。
(1)APOKYN®(盐酸阿扑吗啡注射液),治疗帕金森疾病的急性、间歇发作的低机动性off发作,其皮下注射笔能快速有效的逆转口服左旋多巴安在不能控制的PD中的失效。口服APOKYN的患者在使用后10分钟,能看到95%的OFF episodes 的逆转。
(2)XADAGO(B型单胺氧化酶(MAO-B)抑制剂)为帕金森患者levodopa/carbidopa药物的辅助治疗。
(3)MYOBLOC®(B型肉毒杆菌毒素),治疗颈部肌张力障碍和流涎,是市场唯一的肉毒素B,在用药后2周就能明显改善症状,单次药物注射持续时间为12-16周,流涎病人在使用药物后3个月能明显缓解症状。目前这一药物正在进行临床4期研究,在未来有增加适应症可能。
2. 已上市产品Oxtellar XR和Trokendi XR
Supernus之前在美国已上市产品有Oxtellar XR和Trokendi XR,均为2013年获批。Trokendi XR是每日一次托吡酯(topiramate)缓释产品,用于预防偏头痛和治疗癫痫。Oxtellar XR,每日一次的奥卡西平(oxcarbazepine)缓释产品,最初被批准用于成人部分发作性癫痫发作的辅助治疗,2019年1月,扩大指征范围,6至17岁儿童的部分发作性癫痫发作的单药治疗。产品由公司在美国境内独立推广。Oxtellar XR的专利期将在2027年到期。在Trokendi XR上,公司签订了settlement agreements,允许第三方在2023年1月1日或更早的时候(在某些情况下)让通用版Trokendi XR进行销售。
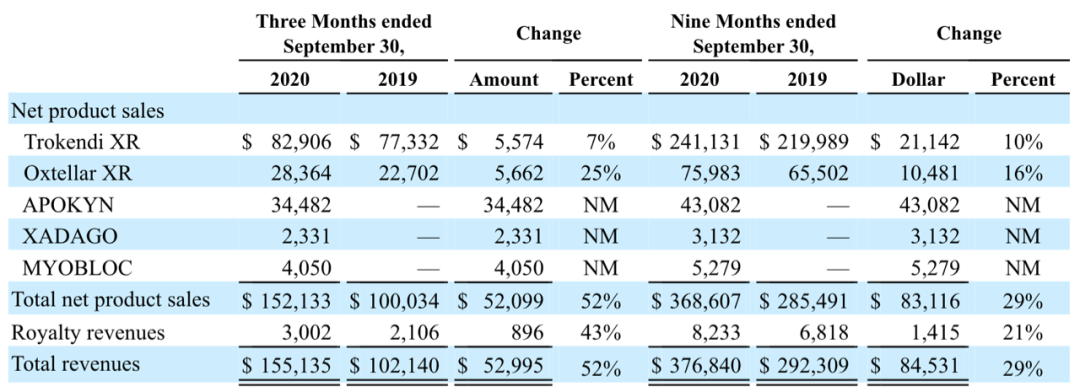
下图为这5个产品的Q3公司收入组成。可以看到,新收购的产品组合,2020年Q3季度的销售额为$40.9M,在公司总的销售额中占的比例为27%,这3个收购的产品组合在2019年全年销售额为$150M。Trokendi XR 的销售额增加7%,主要是由于药物价格今年提高了8%,实际处方量是下降的。Oxtellar XR这个销售额增加25%,是由于药价提高8%,同时处方量增加了。
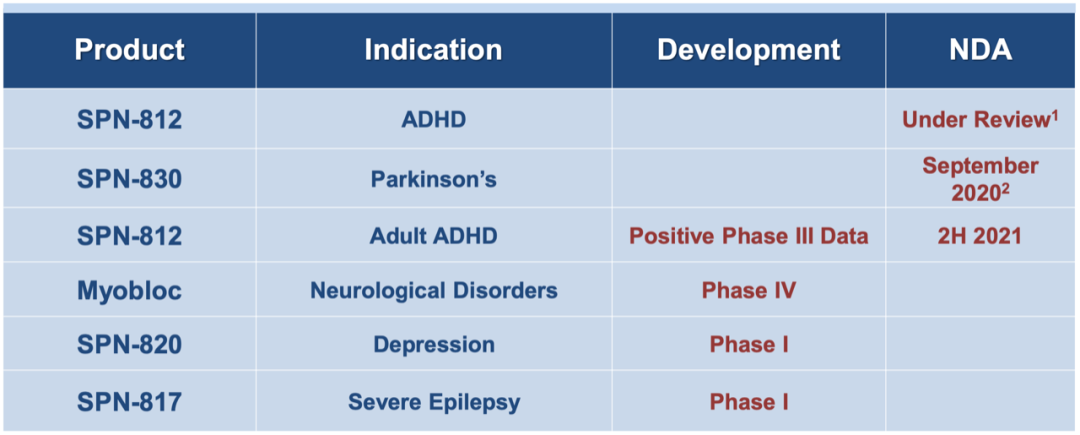
在研管线药物有4个,SPN-812为公司自行研发,指征分别儿童和成人的多动症,目前已出不错的3期临床试验结果。SPN-830管线的Apomorphine Infusion Pump为盐酸阿扑吗啡输液泵,是从USWM收购获得,临床试验已完成3期,治疗帕金森疾病相关指征,收到美国FDA的CRL,准备重新提交材料。SPN-820(NV-5138)是2020年4月从私人公司Navitor Pharmaceuticals获得,Supernus和其共同开发,Supernus可在启动III期临床计划之前,独家选择license-in或收购NV-5138,这一管线将在2021年下半年开始进入临床2期。
SPN-812(盐酸维洛沙嗪,viloxazine hydrochloride),血清素去甲肾上腺素调节剂(SNMA),用于治疗患有ADHD(多动症)的6至17岁儿童和成人。该药物的活性成分盐酸维洛沙嗪在欧洲作为抗抑郁药广泛使用,但剂量更高,在美国则是具有NCE(New Chemical Entity,新化学实体)地位的双环SNMA。
SPN-812在2020年1月提交NDA,PDUFA是11月8日,如果获批,基于其NCE认定会有5年的市场排他(exclusivity)。但在2020年11月收到CRL,主要是设备搬迁,没有关于临床疗效或安全性问题。2021年1月会和FDA举行Type A会议讨论SPN-812和SPN-830的再申请。该药IP截止时间为2029-2023年,由于是美国的NCE药物,如果批准将会增加该药物5年的市场独占权。2021年1月份,公司将与FDA讨论CRL,如果儿童指征今年批准,成人的sNDA将在2021年下半年提交,估计要到2022年上半年批准。
ADHD的2020年的处方量在78 million,这一市场的年复合增长为4%,2019年全年的处方药物市场为$8.5 billion,因此到2027年销售峰值时的市场大小处方量为89-100million。SPN-812的峰值市场占有率根据公司预计在5-10%之间。
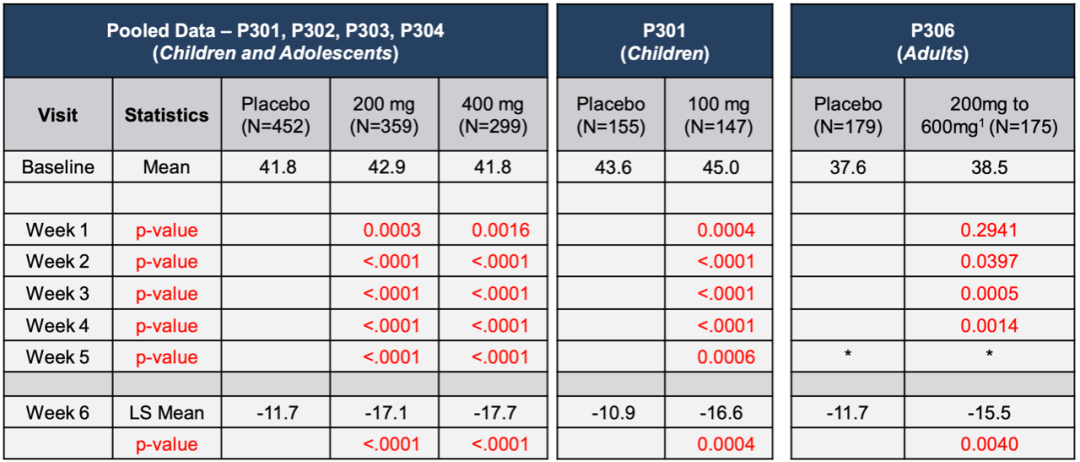
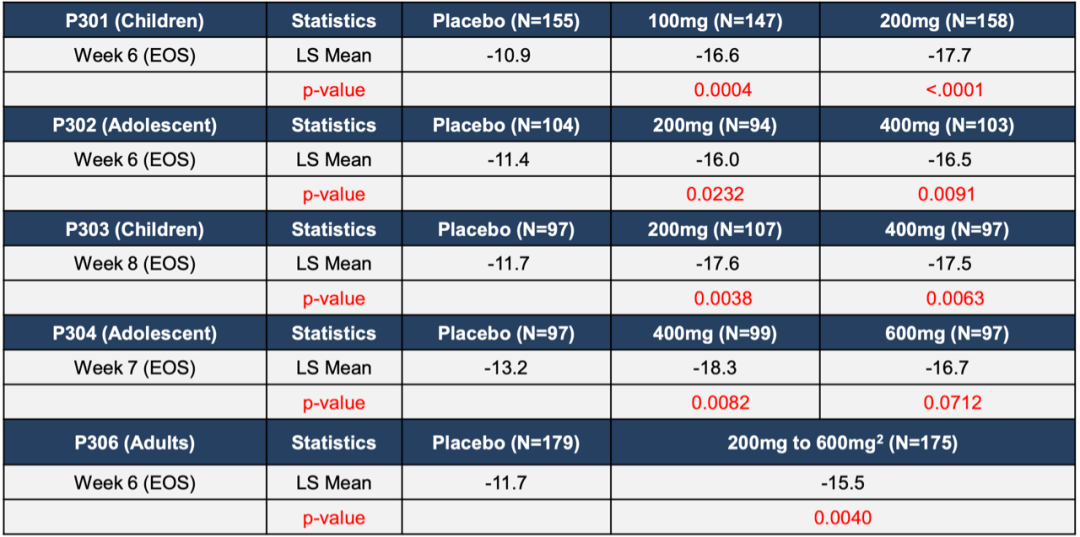
SPN-812 儿童和成人多动症3期临床试验研究数据:
SPN-812的临床3期注册研究由4个3臂、安慰剂对照试验组成,P301和P303针对6-11岁的儿童,P302和P304针对12-17岁的青少年患者,分别在2018年12月和2019年3月宣布阳性结果。公司在2019年Q3开始成人试验P306,在2020年11月也宣布阳性结果。

P301组共入组477例患者,随机分配至安慰剂组、100mg、200mg,治疗组每日1次服用5周。P303入组313例患者,随机分配至安慰剂、200mg、400mg,每日一次服用7周。两个研究主要研究终点为与基线相比,在ADHD评分(RS-5)下的总分变化。
P301组,2018年12月6日宣布达到主要终点,ADHD‑RS‑5评分取得统计学意义改善,100mg和200mg组分别为-16.6分(p=0.0004)和-17.7分(p<0.0001),安慰剂组为-10.9分。耐受性良好。
P303组,200mg和400mg组也取得统计学意义改善,-17.6分(p=0.0038)和-17.5分(p=0.0063),安慰剂组为-11.7分。
P302入组310例患者,随机分为安慰剂、200mg、400mg,主要终点也是ADHD‑RS‑5评分对比基线变化。也达到了主要终点,分别为-16.0分(p=0.0232) 和-16.5分(p=0.0091) 。
P304入组297例患者,随机分为安慰剂、400mg、600mg。400mg达到主要终点,为-18.3分vs -13.2分 (p=0.0082) ,600mg组没有达到统计学意义,改善总分-16.7分( p=0.0712)。
一项多中心的随机、双盲、安慰剂对照的3期临床试验,共入组374名ADHD患者,治疗组第1周每日使用200mg,第2周每日400mg,之后采用灵活剂量每日200-600mg。
在最高每日剂量不超过600mg下,研究达到了主要终点,在ADHD研究者症状分级量表(AISRS)下与基线对比,改善了ADHD症状,并和安慰剂对比取得显著统计学差异,在第6周时治疗组分数下降-15.5,安慰剂组为-11.7(p=0.0040)。此外数据表明药物起效迅速,最早在第2周就达到了统计差异,p值为0.0397,并维持统计学差异直到第6周试验结束时:
SPN-812治疗6-17岁青少年患者的指征已经提交NDA并处于FDA审查阶段,在2020年11月FDA发布完全回复函(CRL)拒绝其上市申请。该公司将于2021年1月与FDA开会讨论该CRL,如儿科指征批准,公司计划在2021年下半年向FDA提交SPN-812治疗成人ADHD的sNDA(补充新药申请)。
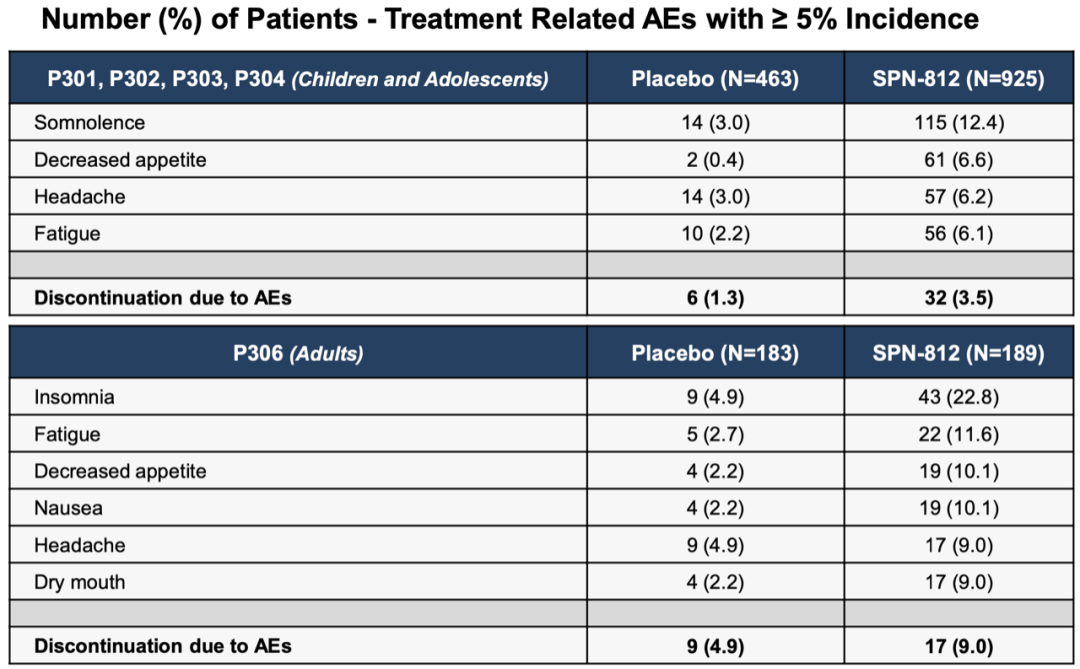
所有剂量的AE发生率均较低。不良事件较轻,不良事件的导致的终止率低,范围从1.3%-9%。SPN‑812的治疗有关AE>5%的为包括嗜睡,疲劳,食欲下降,头痛和恶心。
3.2 SPN-830,Apomorphine Infusion Pump盐酸阿扑吗啡输液泵,收购获得的产品线
该管线为2020年4月从US WorldMeds购入的CNS产品组合,Apomorphine Infusion Pump(盐酸阿扑吗啡输液泵,SPN-830,未上市)。SPN-830在2020年9月提交晚期帕金森适应症,在2020年11月收到FDA的Refusal to File (RTF) letter。FDA认为NDA数据不完整,无法进行实质性审查,要求提交更多文件和报告来支持申请。
NV-5138是一种口服小分子药物,主要激活细胞代谢的主要调节剂mTORC1,mTORC1在患有抑郁症的人中经常被抑制。该管线从Navitor Pharmaceuticals购入,Supernus和Navitor将联合进行药物2期临床,Supernus最多支付5000万美元的2期临床费用,Navitor授予Supernus一项独家选择权,可以在启动III期临床计划之前,在除大中华地区以外的世界范围内,License或购买NV-5138。为换取该权益,Supernus付给Navitor2500万美元的预付款,包括1000万美元的option fee和1500万美元的股权投资,占约13%的Navitor所有权。
如果最终Supernus决定License或购入该管线,总付款额(不包括NV-5138销售额分成和开发成本)有可能达到4.1亿美元-4.75亿美元,其中包括2500万美元的预付款,额外的授权或收购费,以及随后的临床、审批和销售里程碑付款。
3.4 SPN-817 huperzine A(石杉碱甲) 收购获得
2018年从Biscayne Neurotherapeutics, Inc获得,监管里程碑最高为7300万美元,销售里程碑为9300万美元和low single digit 销售分成。
SPN-817(huperzine A,石杉碱甲),也有美国市场NCE认定,目前在对难治性严重癫痫的成年患者进行I期概念验证试验,研究其作为一种非合成石杉碱甲缓释制剂的安全性和药代动力学特征。I期临床试验已经在美国外开始,目前公司正在完成其临床前试验来完善IND,FDA还授予了Dravet Syndrome和Lennox-Gastaut Syndrome的孤儿药认定。公司称其非合成的huperzine A有较大的药物副作用,正在优化新型的口服剂型药物。
除了官网Pipeline显示的SPN-830(Apomorphine Infusion Pump),820(治疗指征为抑郁症)和817(huperzine A,石杉碱甲),在2019年报中,产品线还有SPN-809和SPN-604,SPN-809和SPN-812活性成分一样,指征为抑郁症,从Rune HealthCare Limited获得,处在IND。SPN-604,奥卡西平缓释片(oxcarbazepine),指征双向情感障碍,在2020年3月由于Covid-19宣布暂停临床试验入组。
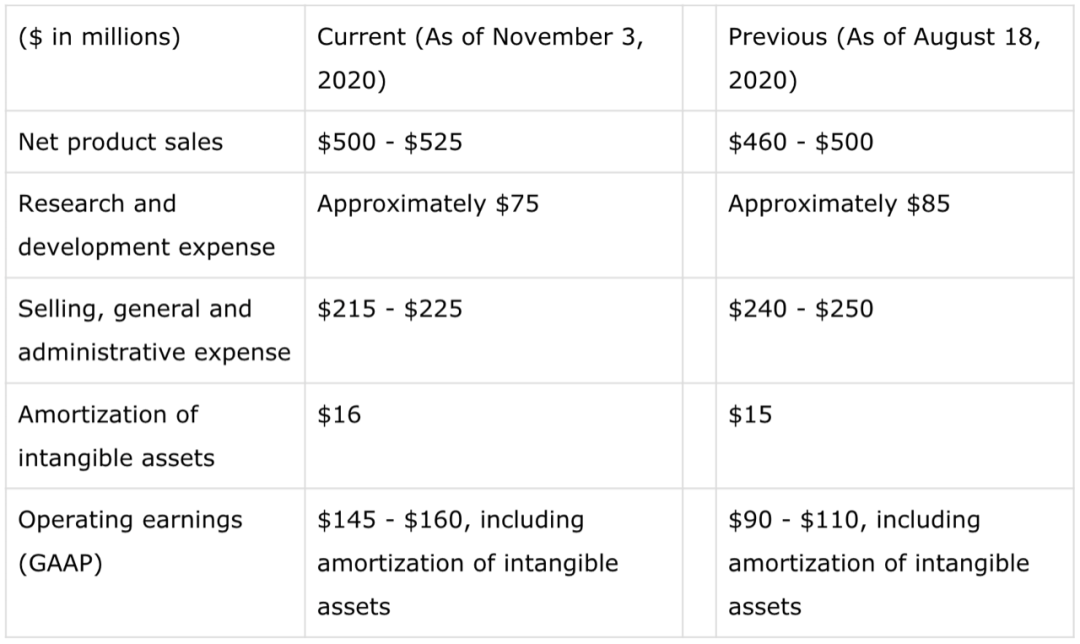
截止2020年9月30日现金$740M,大概有$402.5million的0.625% Convertible Senior Notes Due 2023 (2023 Notes),3季度revenues为$155M,Q3公司运营费用为$98M,3季度公司净利润为40M。对于2020年的financial guidance在3季度报后有所提高,见下表:
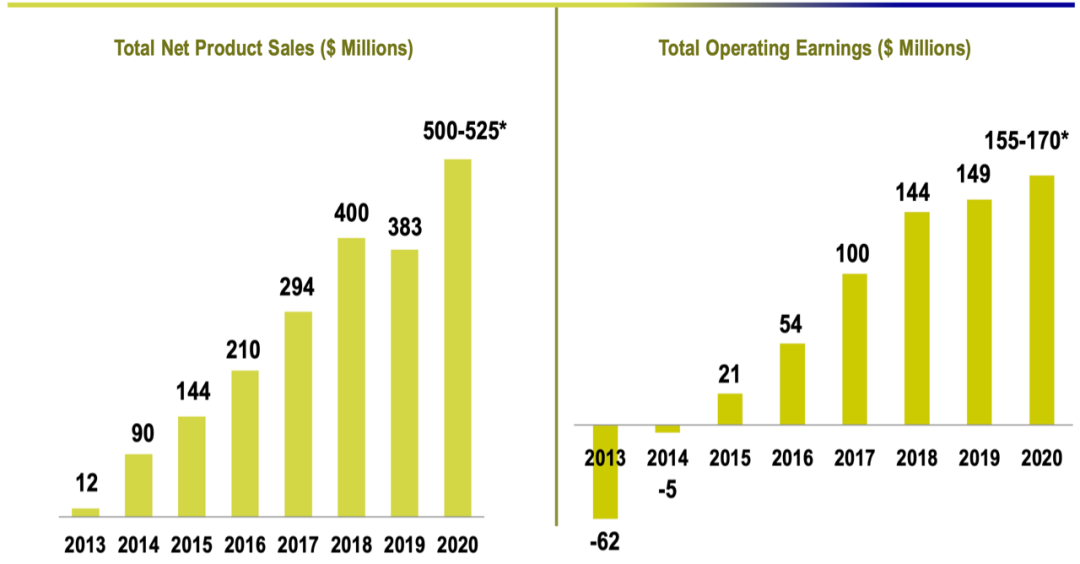
下图为往年和2020年的销售额及公司运营收入的比较。
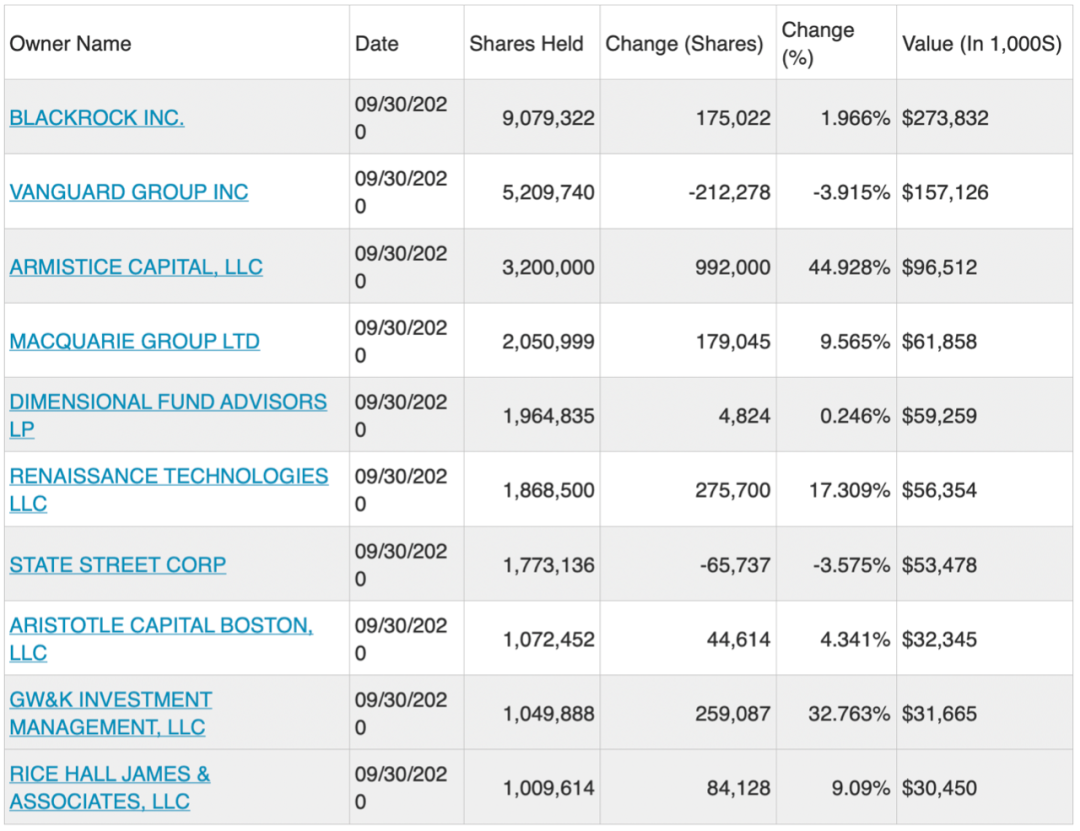
追踪和剖析全球最前沿生物科技公司,寻找低估值/革命性的生物科技产品或技术平台,深入挖掘其投资价值。
联系方式:CaesarBiotech@aliyun.com
Disclosure: I/we are long SUPN.
Disclaimer: 以上的文章及观点并非个人的投资建议,如果想要进行交易,读者需要自己进行勤奋的调研或者咨询专业投资者。我会尽我所能去展示真实的调研,但不能保证信息的精确性。投资这类公司可能会导致本金部分或者全部损失。换而言之,读者需要有自己的交易计划,有自己的研究,并为自己的交易负责。如果没有能力或者意愿去做这些,建议您最好买入指数型ETF基金,或者请您信任的专业人士来处理您的投资账号。














 个人中心
个人中心
 我是园区
我是园区




