

在种类繁多的药物作用机理中,存在一种既传统又新颖的机制——共价抑制机制。说“传统”,是因为共价作用是一种广泛存在的药物机制,许多历史上的经典药物都基于这一原理,甚至可以追溯到阿司匹林和青霉素。说“新颖”,则是因为在这些药物最初发现的时候,人们并没有认识到背后的机制。早期的共价药物多是偶然发现或是筛选获得,人们主动进行共价抑制剂的设计则是相对新兴的药物研发方式。共价药物可以与蛋白质的氨基酸残基结合,改变蛋白质构象从而抑制其生物学功能。因为共价键能量高、亲和力高,所以共价药物能更长时间与靶蛋白结合,并表现出比一般的小分子药物更强的抑制作用。过去这一领域未被充分探索,但是近年来,拥有更高选择性和更强效力的共价抑制剂重新受到了关注。



根据停留时间筛选候选分子与靶点(来源:Nature Chemical Biology)



全球Hsp90靶点药物研发概览(来源:医药魔方NextPharma;数据截至2022-07-08)

重点布局Hsp90靶点的部分机构(来源:医药魔方NextPharma;数据截至2022-07-08)

《创星》系列:
[1]https://terremotobio.com/
[2]Fairhurst, R., Knoepfel, T., Buschmann, N., Leblanc, C., Mah, R., & Todorov, M. et al. (2020). Discovery of Roblitinib (FGF401) as a Reversible-Covalent Inhibitor of the Kinase Activity of Fibroblast Growth Factor Receptor 4. Journal Of Medicinal Chemistry, 63(21), 12542-12573.
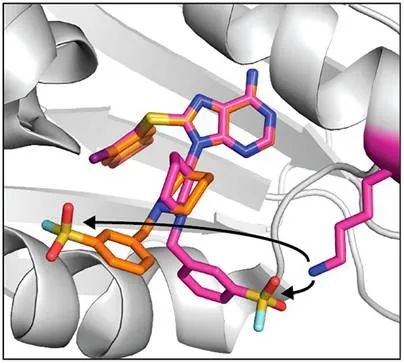
[3]Yang, T., Cuesta, A., Wan, X., Craven, G., Hirakawa, B., & Khamphavong, P. et al. (2022). Reversible lysine-targeted probes reveal residence time-based kinase selectivity. Nature Chemical Biology.
[4]Cuesta, A., Wan, X., Burlingame, A., & Taunton, J. (2020). Ligand Conformational Bias Drives Enantioselective Modification of a Surface-Exposed Lysine on Hsp90. Journal Of The American Chemical Society, 142(7), 3392-3400.
[5]Wan, X., Yang, T., Cuesta, A., Pang, X., Balius, T., & Irwin, J. et al. (2020). Discovery of Lysine-Targeted eIF4E Inhibitors through Covalent Docking. Journal Of The American Chemical Society, 142(11), 4960-4964.
100个新靶点(后台回复靶点,获取相关Excel)
AACR资料包(后台回复AACR,获取资料合集)
2022 ASCO资料包(后台回复ASCO,获取20份PPT合集)



 个人中心
个人中心
 我是园区
我是园区




