
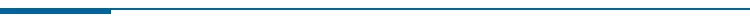
 图 | 近 5 年媒体对 RWD 研发或融资事件的曝光量统计(来源:
CB Insights 中国)
图 | 近 5 年媒体对 RWD 研发或融资事件的曝光量统计(来源:
CB Insights 中国)

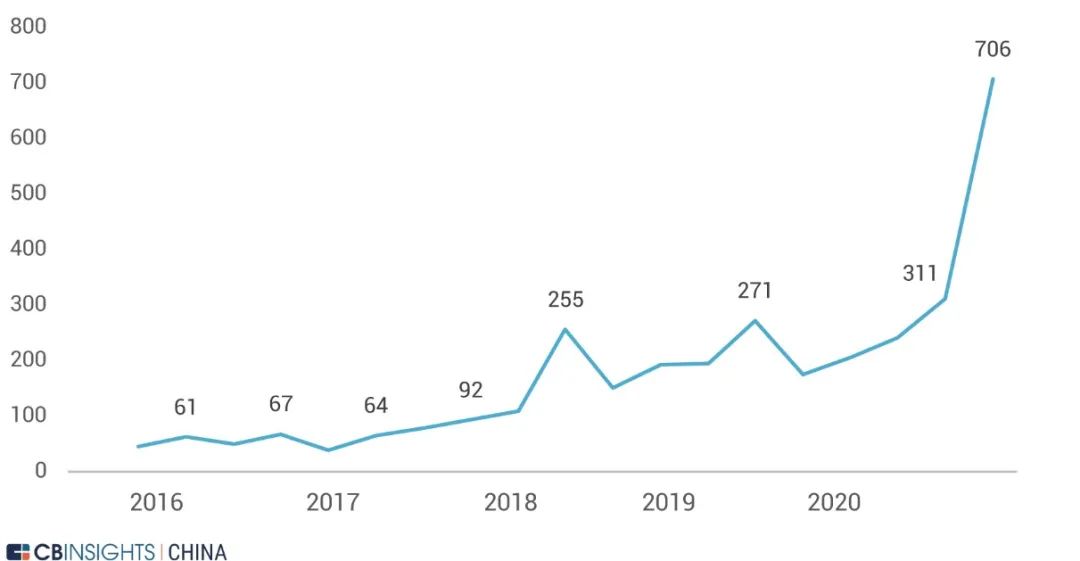
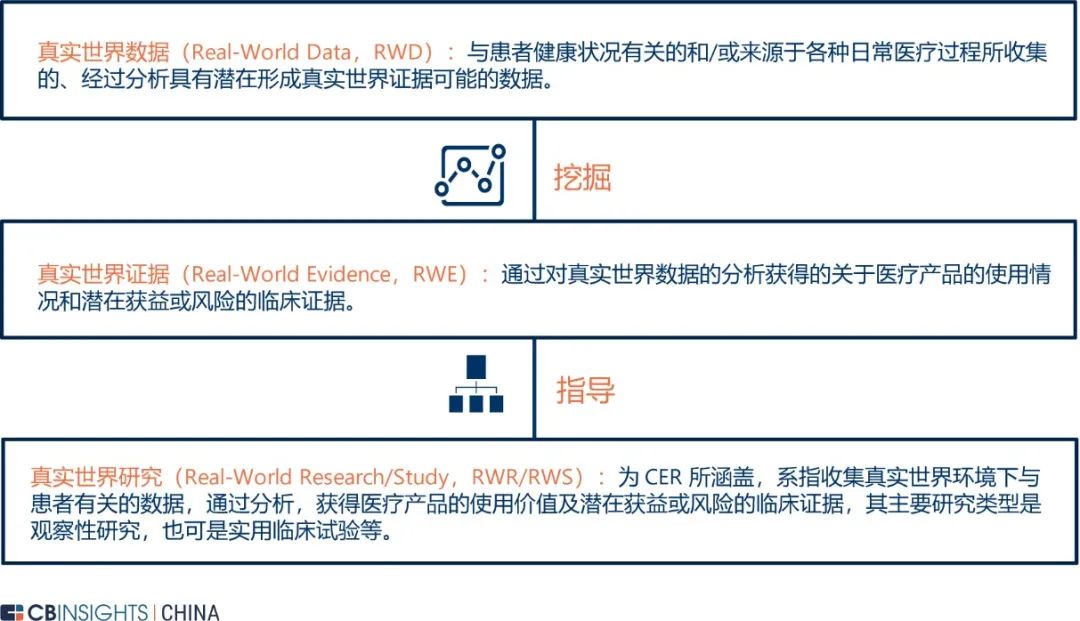 图 | 中国关于真实世界数据相关概念的解释(来源:
CB Insights 中国)
图 | 中国关于真实世界数据相关概念的解释(来源:
CB Insights 中国)
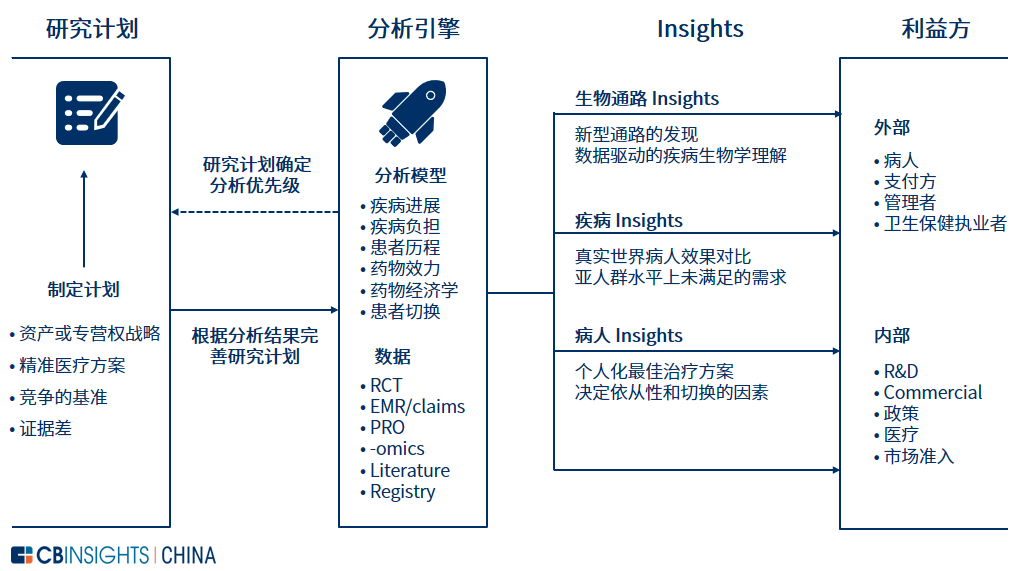 图 | 先进的 RWD 解决方案模型(来源:
麦肯锡,CB Insights 中国整理)
图 | 先进的 RWD 解决方案模型(来源:
麦肯锡,CB Insights 中国整理)
 图 | 产生效力-效果差的原因(来源:
CB Insights 中国)
图 | 产生效力-效果差的原因(来源:
CB Insights 中国)
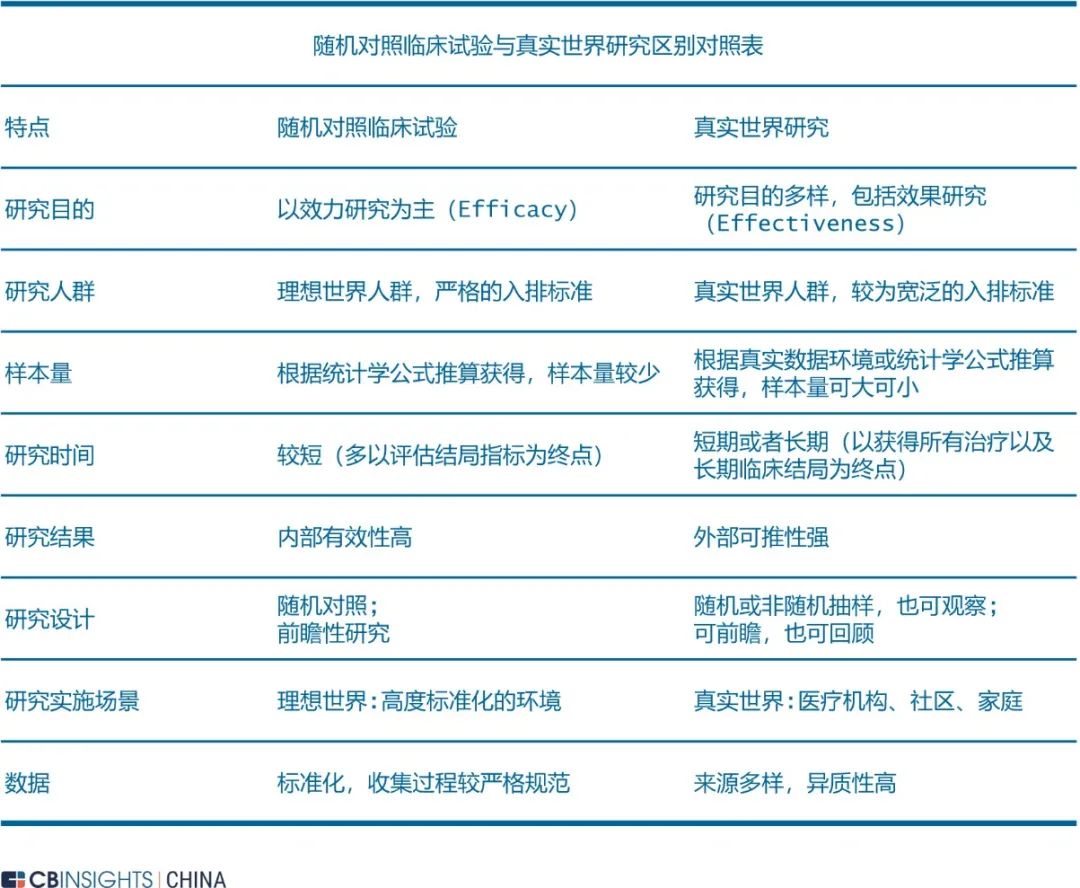
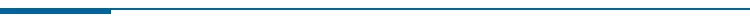
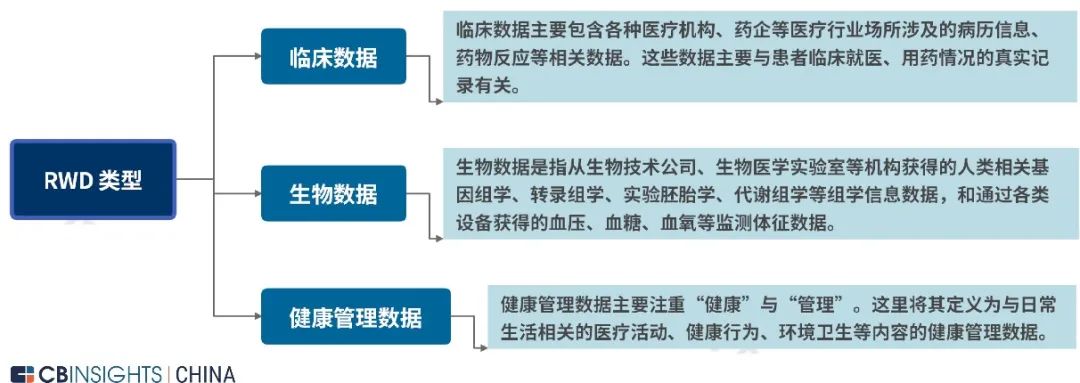
 图 | 真实世界数据来源 (来源:
CB Insights 中国)
图 | 真实世界数据来源 (来源:
CB Insights 中国)
辅助罕见病药物研发:罕见病治疗药物临床试验除病例稀少、招募困难外,最大的挑战是对照的选择。因此,以自然疾病队列形成的真实世界数据就可以作为外部对照。2017 年 FDA 加速批准 PD-L1 抗体 Avelumab ,用于≥12 岁进行性转移性默克尔细胞癌(MCC)患者。案例中美国 FDA 首次基于电子健康记录来源的的 RWE 支持药物获批。批准上市主要基于一项单臂二期临床试验,包括 35 个癌症中心的 88 名患者观察到 ORR 33% 和 86% 持久应答率(≥6个月),还包括来自 iKnowMed 数据库的历史数据。
修订适应症或联合用药范围,或为已上市药物的说明书变更提供证据:当 RCT 不可行或非最优的研究设计时,采用 PCT 或观察性研究等生成的真实世界证据支持新增适应症可能更具可行性和合理性。2019 年 4 月,美国 FDA 批准辉瑞乳腺癌疗法 Ibrance(palbociclib)与芳香酶抑制剂或氟维司群(fulvestrant)联用,治疗 HR+, HER2- 晚期或转移性男性乳腺癌患者。这一批准并不依赖于临床研究,而是基于电子病历和药物上市后真实世界中男性患者使用 lbrance 的数据。
辅助中医经验方、中药医疗制剂的研发:对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路径。
2019 年,广州市大湾区中医药真实世界研究中心成立。这是中国第一所专注于基于家庭医生开展中医药真实世界研究的科研机构,旨在将真实世界研究的方法论运用到中医药行业,支持中医药事业传承创新发展,推动中医药走向现代化。
辅助医疗器械研发:临床急需进口器械在国内使用,可用真实世界数据作为已有证据的补充,用于支持产品注册。2019 年 6 月,国家药监局与海南省人民政府联合启动了海南临床真实世界数据应用试点工作,探索将临床真实世界数据用于药品医疗器械产品注册和监管决策实践。2019 年 12 月起,美国艾尔建公司“青光眼引流管”产品开始收集用于评估人种差异的境内临床真实世界证据,并于 2020 年 3 月成为国内首个通过该途径获批上市的医疗器械产品。
真实世界数据可加速药物上市:2021 年 4 月 7 日,欧康维视生物宣布其核心品种治疗慢性非感染性葡萄膜炎产品 OT-401(氟轻松玻璃体植入剂)的新药上市申请正式获国家药监局受理。其公司提交给国家药监局的申报资料,是 OT-401 在海南博鳌乐城国际医疗旅游先行区真实世界数据研究中的 28 例受试者数据,以及该药品在境外已经完成的三期临床试验数据。这是中国药品注册史上第一个完全基于真实世界研究数据申报上市的新药。真实世界数据研究使这款药的商业化进程大约加快了一年半。
促进已发现生物标志物的临床转化:生物标记物的发现多始于基础研究,从发现到临床应用仍需要一段较长的过程。用真实世界数据辅助生物标志物的临床转化仍处在研究的初期,但是在 ClinicalTrial 上已经有相关案例。阿斯利康与德国图宾根大学在 2017 年 3 月 - 2019 年 5 月展开了关于国际乳腺癌生物标志物护理标准的真实世界结果研究。比利时根特大学医学院 2021 年 1 月启动了动态增强 CT(DCE-CT)作为治疗胸腔肿瘤监测的早期生物标志物的真实世界研究,预计2022 年12月月终止。两项研究都是用真实世界数据进一步辅助促进了已发现的生物标志物的临床转化。
促进新生物标志物的发现:在真实世界数据库中,用更多的患者样本和亚群体,不仅可以加快已有生物标物的临床落地,还可以通过多组学分析寻找新的生物标志物。2020 年美国食品和药物管理局器械与放射卫生中心在《临床转化医学》上公开发表文章,用计算机模拟研究说明了基于 RWD 的证据方法,可能有助于成本/时间效率高的生物标志物发现,从而为医疗产品的使用提供信息。
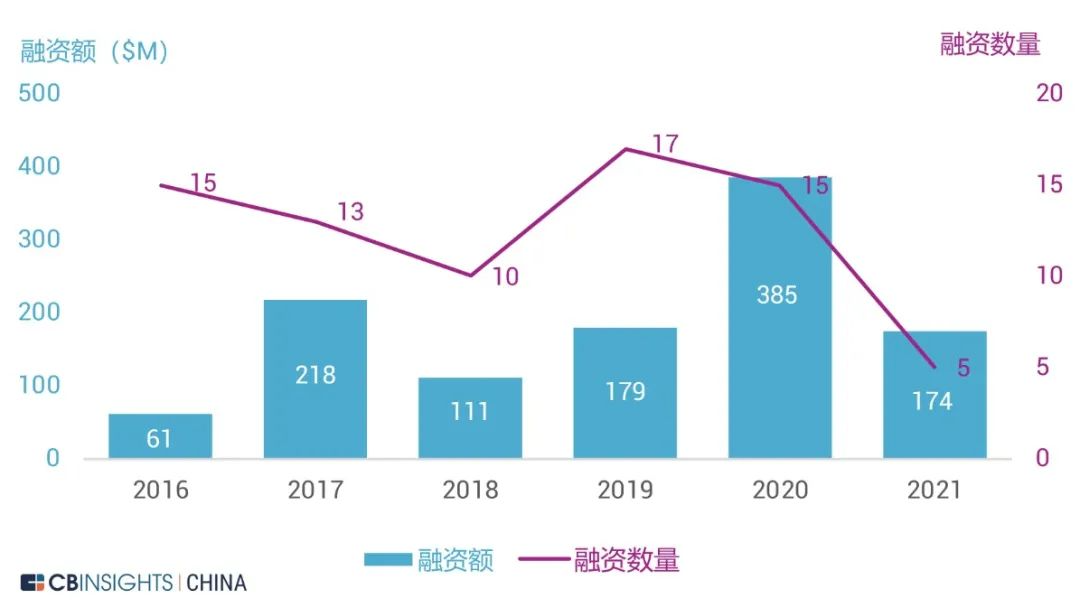 图 | 股权融资额及数量(来源:CB Insights 中国)
图 | 股权融资额及数量(来源:CB Insights 中国)
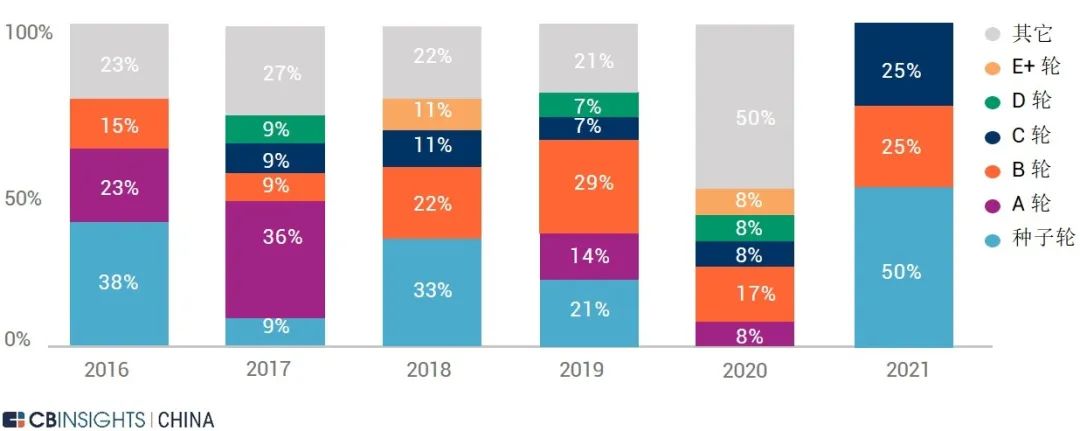 图 | 股权融资轮次分布(来源:
CB Insights 中国)
图 | 股权融资轮次分布(来源:
CB Insights 中国)
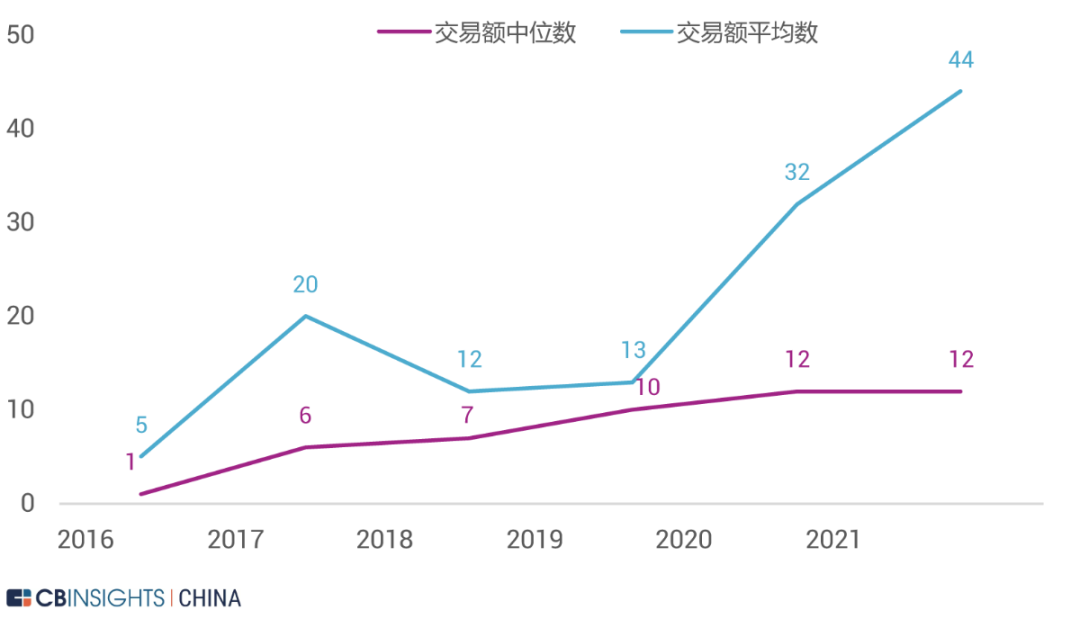
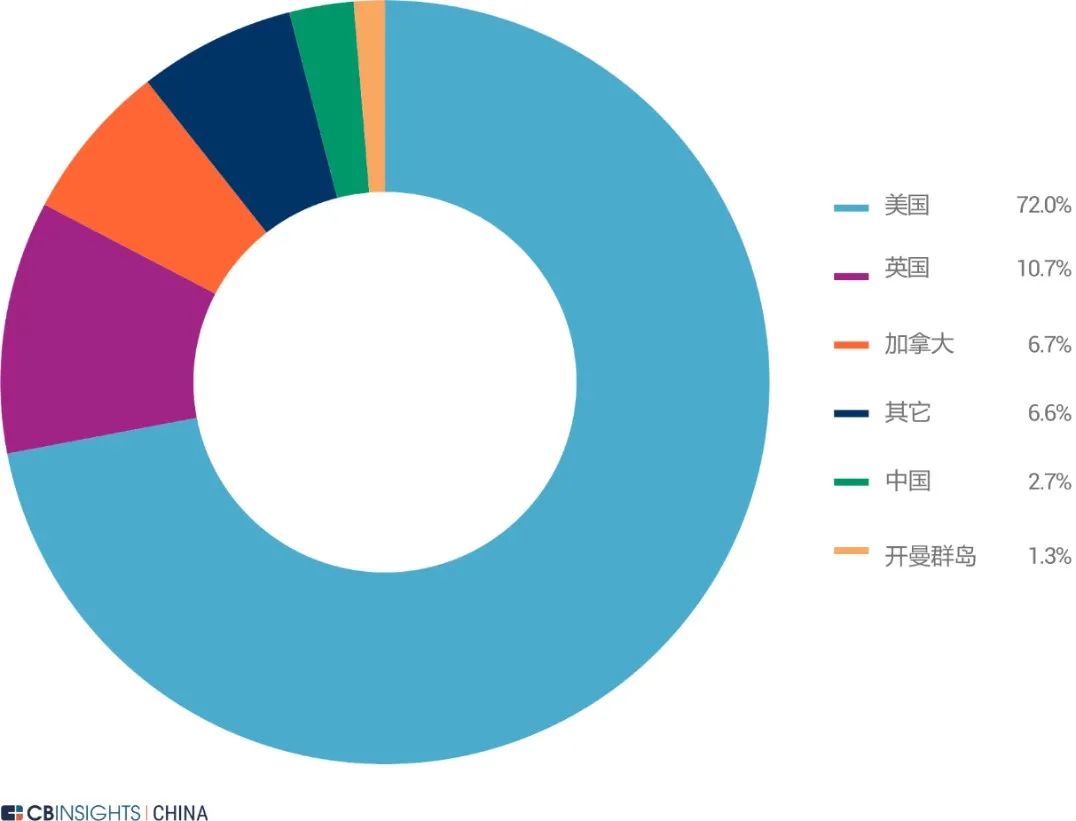 图 | 国家及地区分布(来源:
CB Insights 中国)
图 | 国家及地区分布(来源:
CB Insights 中国)
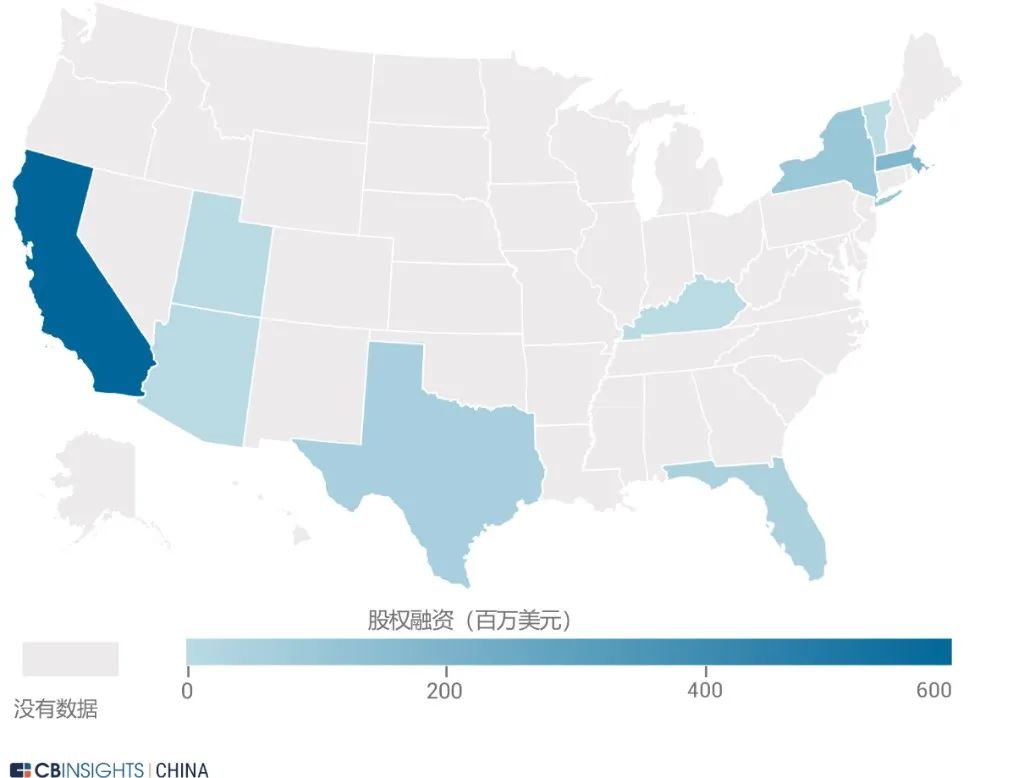
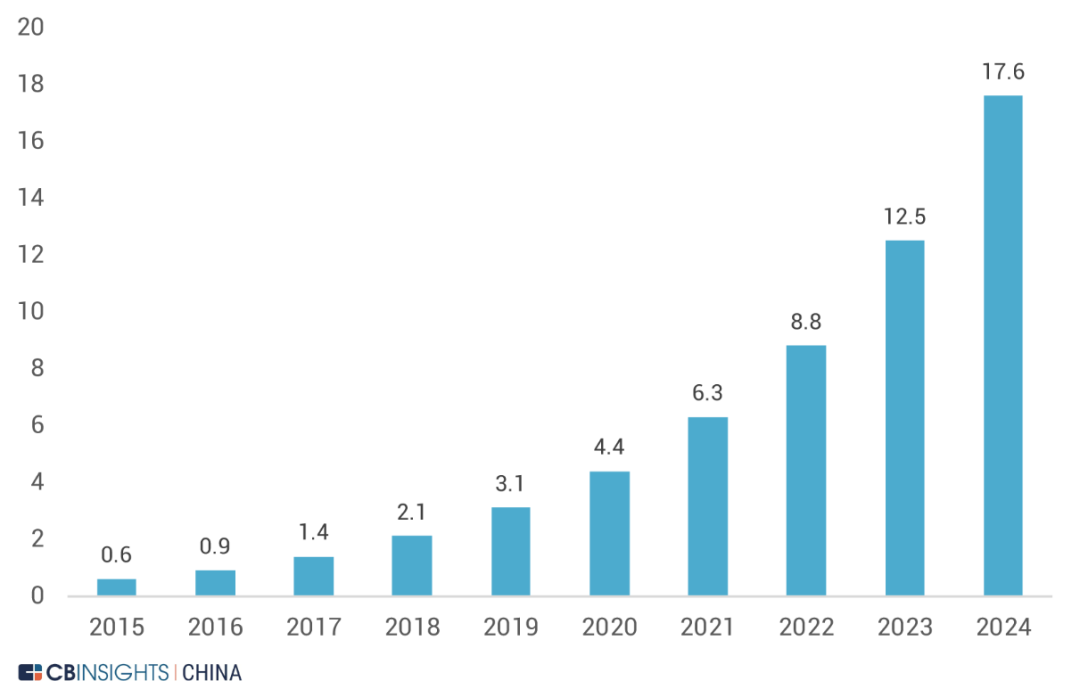
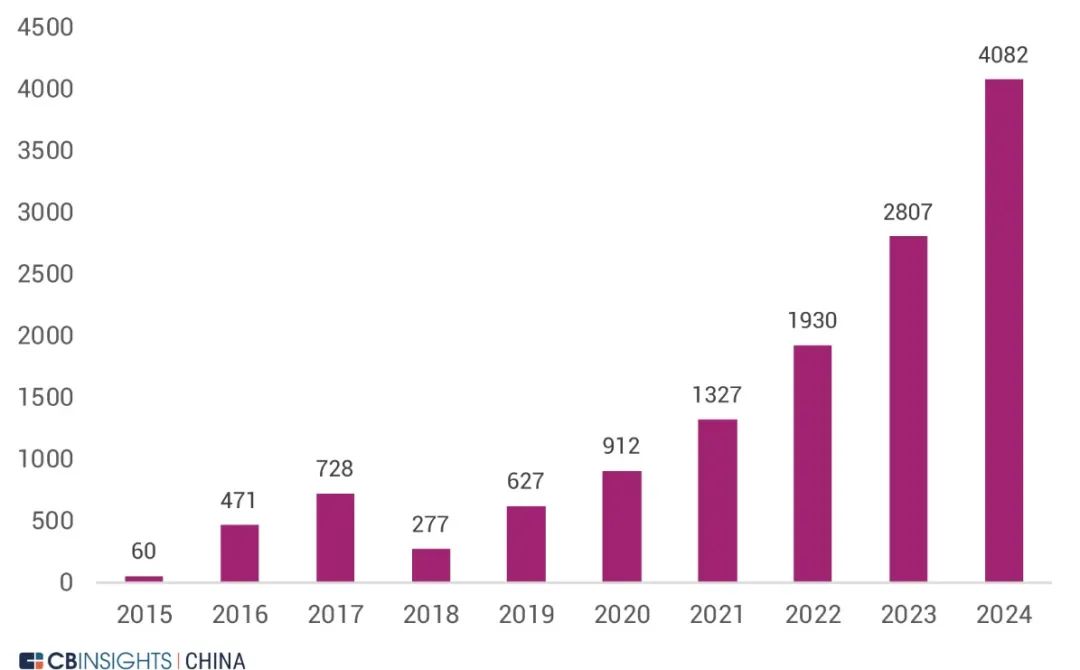
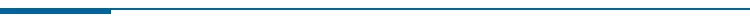

 图 | RWD 中国行业法规(来源:
CB Insights 中国)
图 | RWD 中国行业法规(来源:
CB Insights 中国)
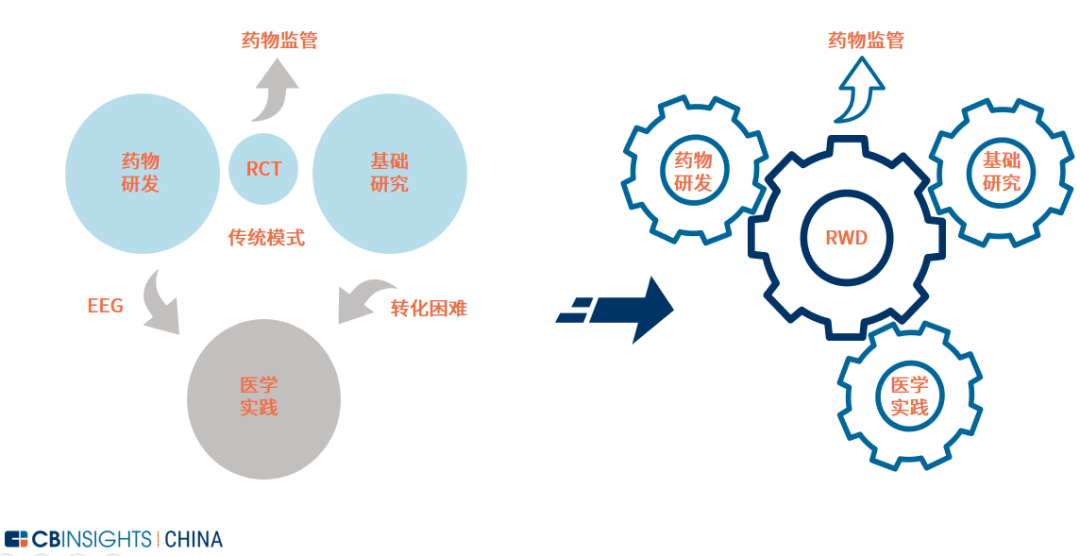
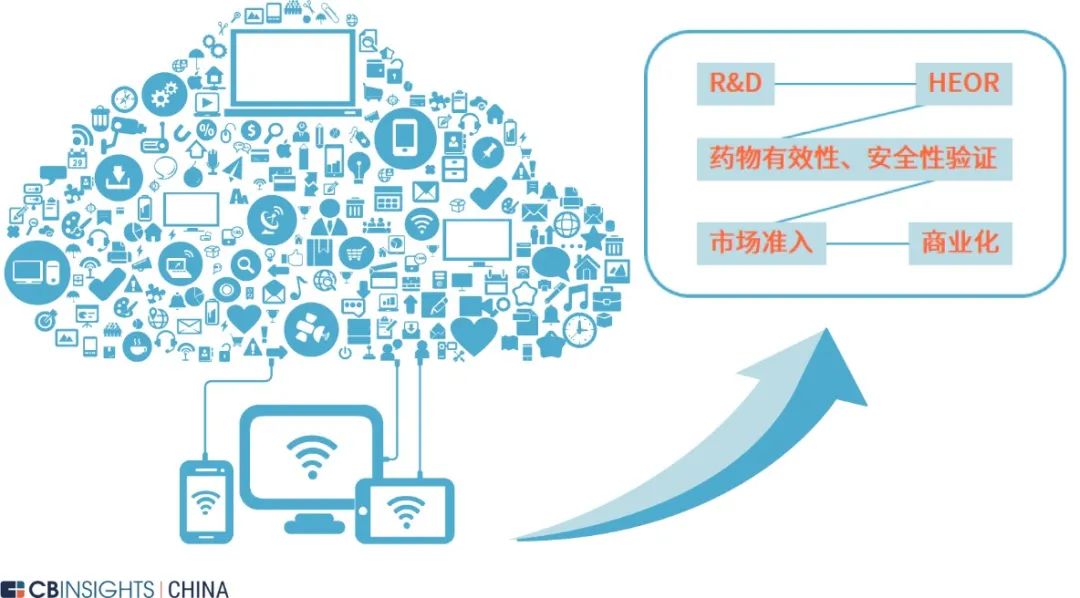 图 | RWD 深度赋能药物研发生命周期链(来源:
CB Insights 中国)
图 | RWD 深度赋能药物研发生命周期链(来源:
CB Insights 中国)
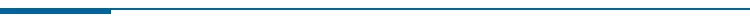
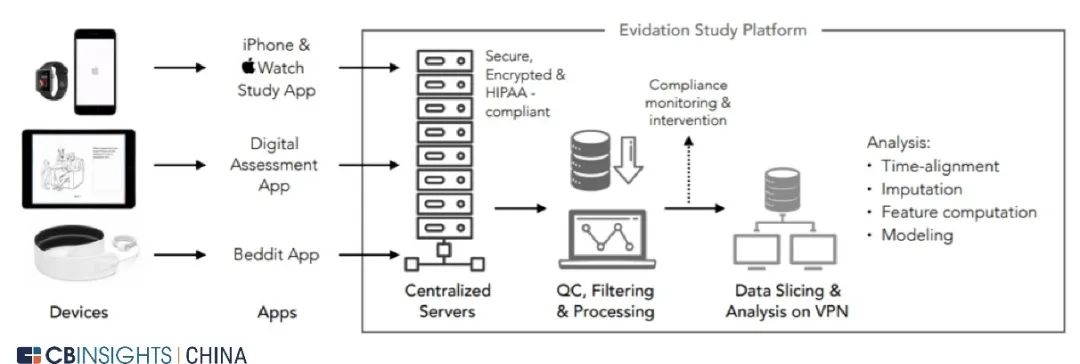
 图
| 从原始数据源到研究结果的工作流决策(来源:
Aetion 官网,CB Insights 中国整理)
图
| 从原始数据源到研究结果的工作流决策(来源:
Aetion 官网,CB Insights 中国整理)
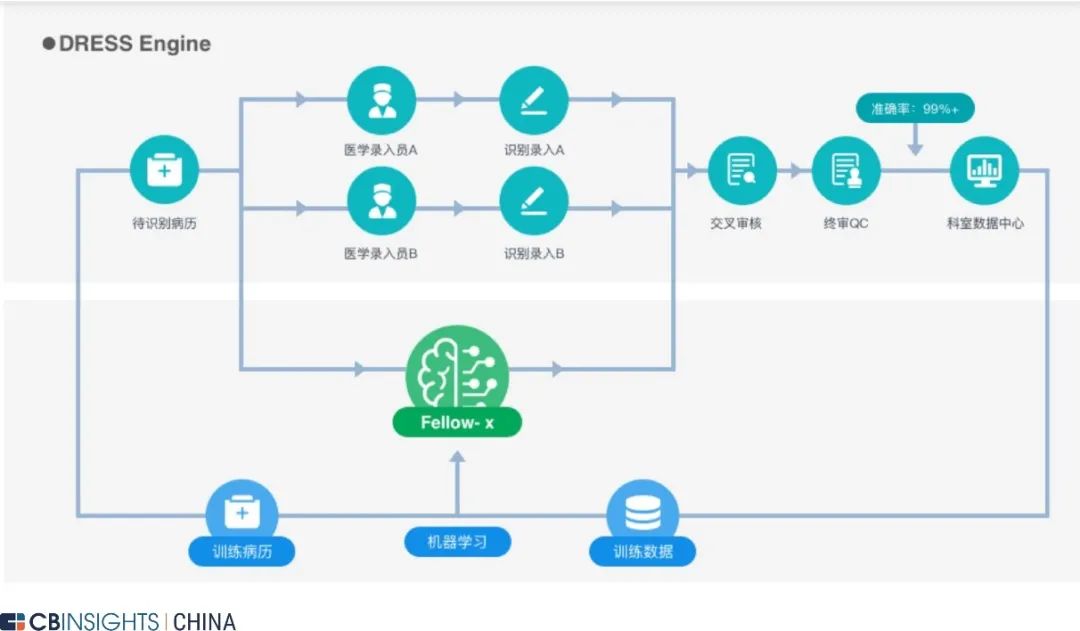
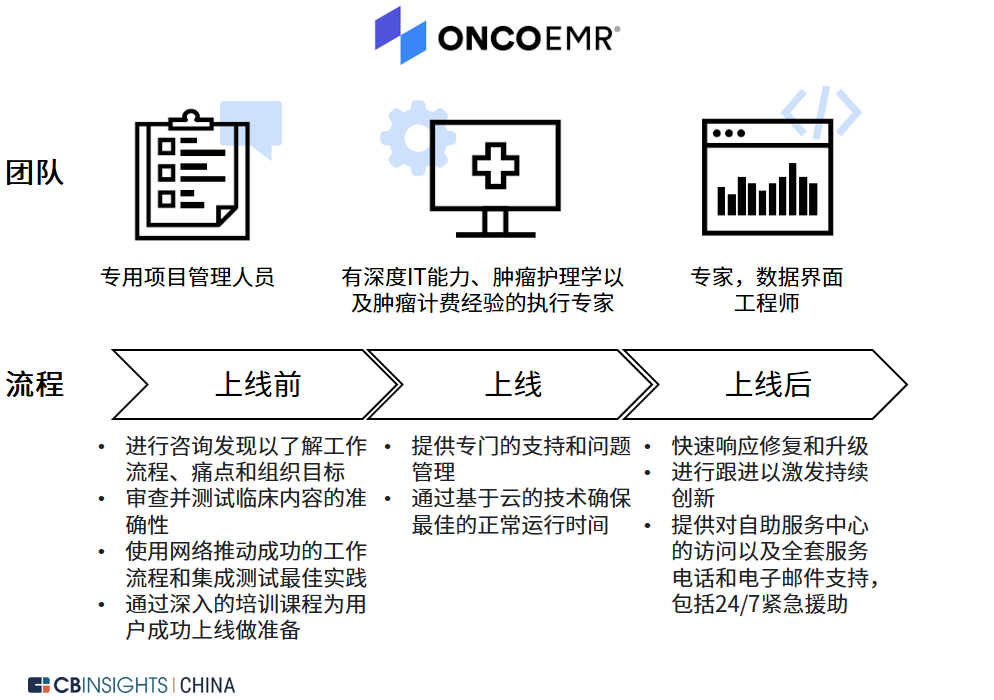 图 | Flatiron 特色平台 OncoEMR 架构(来源:Flatiron 官网,
CB Insights 中国整理)
图 | Flatiron 特色平台 OncoEMR 架构(来源:Flatiron 官网,
CB Insights 中国整理)




 个人中心
个人中心
 我是园区
我是园区




