
自20世纪60年代首次在动物模型中进行试验以来,抗体-药物结合物
(Antibody-drug conjugates,ADC)
经历了几次热潮。20世纪80年代开展了第一次ADC临床试验,首个ADC药物Mylotarg则于2000年首次获得批准。然而Mylotarg被撤市引起行业剧震,好在随后在2017年重新上市。
2010年代,一些临床和商业上成功的药物
(如Adcetris)
上市重新激发了人们对ADC模式的热情,带来了一波投资浪潮。后来,被抱以厚望的PDB二聚体疗法
(如Stemcentryx的SCLC药物)
由于旁观者毒性等因素,其临床试验失败再次令该领域恐慌,引发是否可以在初始成功之外获得有意义的治疗指标的争论。
过去4年中,
有多达8个ADC获得批准
。一系列令人印象深刻的新临床数据,以及如Gilead210亿美元收购Immunomedics等惊人的估值收购,使ADC药物重新被广泛关注。
传统的基于小分子的ADC在三阴性乳腺癌等难以治疗的适应症中显示出有意义的优势;而新的药物设计模式也正在涌现,如新的有效载荷类别包括寡核苷酸、蛋白质和降解物等。ADC正在肿瘤学以外的新适应症中进行测试,新的linker和抗体工程技术正在使靶向元件和弹头具有巨大的多样性。该领域似乎正处于另一个指数增长阶段。
Drughunter
汇总了
FDA批准的ADC药物及其靶点和一些代表性弹头的结构
(下图):
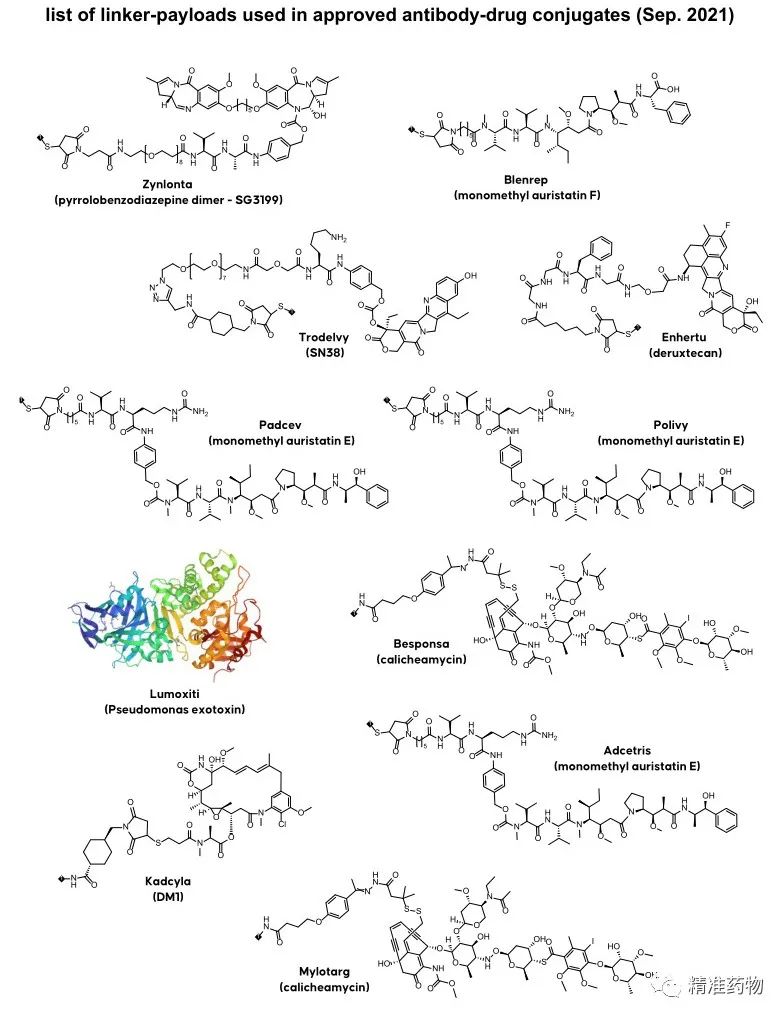
Drughunter另外一张图片汇总了
FDA批准的ADC中使用的linker、有效载荷及弹头
:

版权声明/免责声明
本文为授权转载文章,仅代表作者观点,版权归作者。
仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
欢迎朋友们批评指正!衷心感谢!
文中图片、视频为授权正版作品,或来自微信公共图片库,或取自网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系(电话:13651980212。微信:27674131。邮箱:contact@drugtimes.cn)。衷心感谢!
 点击这里,与~20万同药们喜相逢!
点击这里,与~20万同药们喜相逢!




 点击这里,与~20万同药们喜相逢!
点击这里,与~20万同药们喜相逢!


 个人中心
个人中心
 我是园区
我是园区




