
// 导语:
///
今日,中国国家药监局药品审评中心(CDE)最新公示,由思路迪药业提交注册申请的恩沃利单抗(又名KN035,envafolimab)被纳入拟优先审评名单。恩沃利单抗是一种可用于皮下注射的PD-L1单克隆抗体,本次申请的适应症为:拟开发用于治疗特定的晚期结直肠癌、晚期胃癌及其他晚期实体瘤。今年1月,美国FDA已授予恩沃利单抗晚期胆道癌的孤儿药资格。本次被CDE纳入优先审批,有望再次扩大适应症。

截图来源:CDE官网
全球首个可皮下注射给药的PD-L1 独特设计 可常温保存
恩沃利单抗是一款PD-L1单域抗体Fc的融合蛋白,由康宁杰瑞和思路迪共同开发,先声药业拥有在中国营销及推广其在所有肿瘤适应症的独家权利。
该药的两大亮点除了靶点是PD-L1,更重要的是单域单抗,又称纳米抗体(nanobody)或重链抗体(heavy chain antibody,hcAb)。
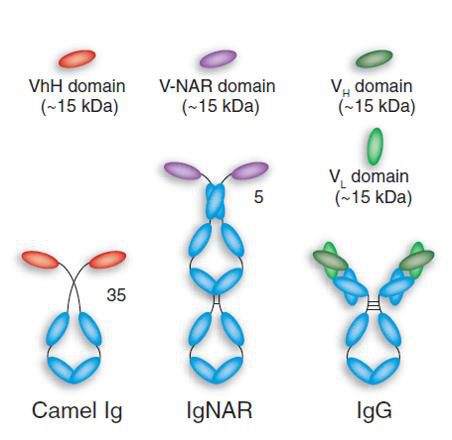
与传统抗体不同的是,单域单抗的体积约为传统抗体的1/10且仅由重链构成,其抗原结合区仅是一个通过铰链区与Fc区连接的单结构域,而且这个抗原结合区自抗体上分离后仍具有结合抗原的功能,这就为抗体的分子构建提供了一个新方法。非但安全性不错,还不需要冷链了,常温保存的,这意味着对整个社会资源、成本都会革命性降低。
此外,传统的PD1/L1在给药方式上均为静脉输注,患者依从性差且不良反应严重。KN035的差异化优势在于可皮下注射,常温下稳定,能提高患者依从性,改善患者生活质量,与目前已经上市和在研的 PD-L1抗体相比给药方式优势明显,对于不适合输液患者,可大大提高患者依从性。也是未来实现肿瘤长期管理的重要希望。同时,它还具有亲和力高,肿瘤穿透速度快,保留时间长,制剂稳定性好,以及工艺先进,成本低等优点。
根据CDE公示信息,恩沃利单抗本次因符合附条件批准被纳入拟优先审评,该药拟开发的适应为:既往接受过氟尿嘧啶类、奥沙利铂和伊立替康治疗的微卫星高度不稳定(MSI-H)晚期结直肠癌,既往至少一线标准治疗失败的MSI-H晚期胃癌,及其他既往至少一线标准治疗失败的DNA错配修复功能缺陷(dMMR)晚期实体瘤。
今年,KN035亮相ASCO大会,两项研究均让人眼前一亮,一起来看一下~
MSI-H晚期结直肠癌二线ORR高达54.2%
第一项研究(摘要号:3021,注册号: NCT03667170)是评估恩沃利单抗在MSI-H/dMMR晚期实体瘤患者中的安全性和抗肿瘤活性的开放标签II期研究。研究纳入了中国25个中心招募103名MSI-H / dMMR晚期癌症患者。研究主要终点为ORR。
发布的试验数据截止到2019年12月17日。结果显示主要疗效人群(PEPi)包括39例既往至少接受过含氟尿嘧啶类、奥沙利铂和伊立替康方案治疗的晚期结直肠癌(CRC)和11例既往至少接受过一线标准治疗的晚期胃癌(GC),中位随访时间为7.5个月。总体人群包括65例CRC(24例先前接受过氟尿嘧啶和奥沙利铂或伊立替康治疗),18例胃癌和20例其他瘤种,中位随访时间为6.7个月。
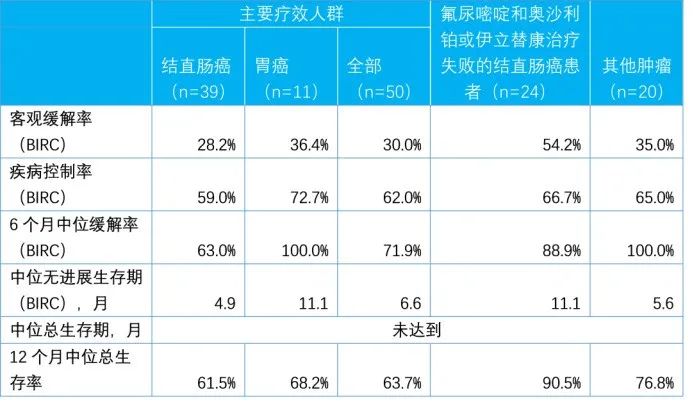
PEPi人群中经确认的客观缓解率为30%(95%CI:17.9%,44.6%),80%的缓解率在数据截止时仍在持续。
先前接受氟尿嘧啶和奥沙利铂或伊立替康治疗的CRC患者中ORR为54.2%(95%CI:32.8%,74.4%)。
总体人群经确认的客观缓解率为34.0%(95%CI:24.9%,44.0%),85.7%的缓解在数据截止时仍在持续。PEPi和总体人群的中位无进展生存期均为6.6个月。
14名患者(13.6%)发生3–4级与治疗相关的不良事件(TRAE)。没有5级TRAE、肺炎或结肠炎的报道。9例患者发生了局部注射部位反应,均为1级或2级。
晚期胃癌二线ORR60%
第二项是探索恩沃利单抗联合FOLFOX作为晚期胃癌/胃食管结合部肿瘤一线治疗的安全性和有效性的研究(摘要号:16585,注册号:CTR20181124)。
入组患者为未经治疗的晚期G/GEJ肿瘤成人受试者,接受8个周期(每2个周)恩沃利单抗联合FOLFOX的治疗。主要终点是安全性和耐受性;次要终点包括:ORR,DOR, PFS,详见下图。

结果显示:共15名患者疗效可评估。80%受试者的ECOG评分为1。大多数人为胃癌(86.7%)。数据截止时,最短随访时间为6个月。
治疗期间不良事件(TEAE)发生率为100%(所有级别)和73.3%(3-4级)。最常见的3-4级TEAE包括中性粒细胞减少46.7%、贫血20.0%、血小板紊乱20%(3/15)。
确认的ORR为60%(确认以及未确认的ORR:73.3%)。
DOR未达到。中位PFS为6.8个月。
两项研究均支持恩沃利单抗作为一种新的有前途的和方便的治疗选择,对之前已接受治疗的晚期MSI-H/dMMR癌症患者具有持久的益处,或可成为晚期G/GEJ肿瘤的一线治疗方案。
治疗晚期胆道癌被FDA授予孤儿药资格 多项研究正在开展
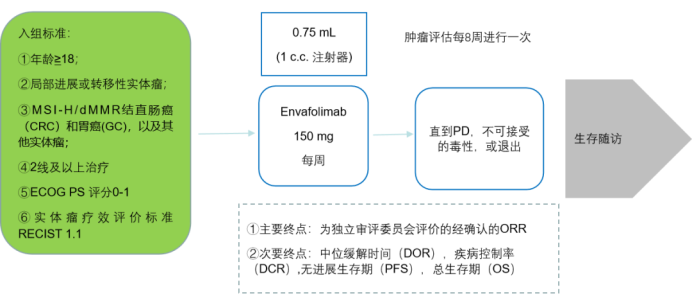
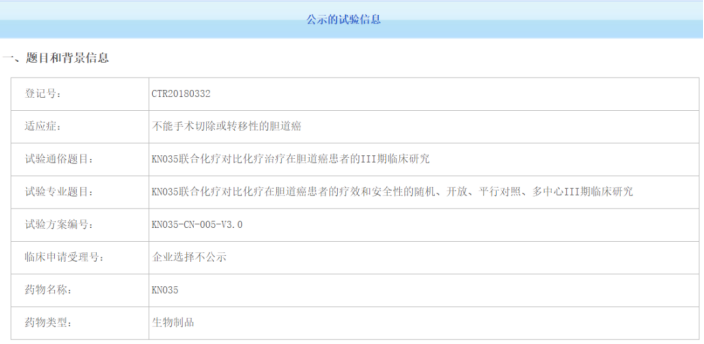
今年1月,美国FDA已授予恩沃利单抗晚期胆道癌的孤儿药资格。目前针对该药的研究是随机、开放、平行对照、多中心的III期临床试验,旨在探索KN035联合化疗对比化疗在晚期胆道癌患者的疗效和安全性。作为全球第一个针对胆道癌一线治疗的三期随机对照研究恩沃利单抗,瞄准未被满足的临床需求,在国内外都具有创新性。该试验由解放军东部战区总医院全军肿瘤中心秦叔逵教授领导,目前进展顺利。该试验的主要研究终点为总生存期(OS),次要研究终点为无进展生存期(PFS),客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)和疾病进展时间(TTP)。期待该实验的阳性结果。
目前,恩沃利单抗正在中国、美国和日本针对多个肿瘤适应症同步开展临床试验,除了在我国开展的晚期胆道癌的3期临床试验。针对结直肠癌及其他晚期实体瘤的2期临床试验也正在开展。
参考文献:
1. 中国国家药监局及药品审评中心官网
2. 2020ASCO
往期推荐

声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
本文版权归找药宝典所有,任何个人或机构转载需获得找药宝典授权,在授权范围内使用,并标注来源“找药宝典”。
文章转载、媒体合作请联系小编:p88128812
参加临床试验请点击文末“阅读原文”报名



 个人中心
个人中心
 我是园区
我是园区




