作者:林出
微信公众号:蹊之美股生物医药 / CaesarBiotech
标的公司:Apellis Pharmaceuticals, Inc. (NASDAQ:APLS)
Apellis Pharmaceuticals (APLS) 宣布FDA已批准Empaveli(pegcetacoplan)治疗成人阵发性夜间血红蛋白尿(PNH),这是一种罕见的危及生命的血液病。Empaveli是首个结合互补蛋白C3靶向PNH治疗。

PNH的特点是红细胞破坏、贫血(红细胞不能将足够的氧气输送到组织)、血凝块和骨髓功能受损(没有制造足够的血细胞)。每百万人中有1-1.5人感染这种疾病。发病时间通常在35到40岁。PNH确诊后中位生存期为10年。
PNH是由影响红细胞的基因突变引起的。有这些突变的人的红细胞有缺陷,可以被免疫系统破坏,从而导致贫血。
Empaveli的有效性在一项研究中进行了评估,该研究纳入了80名服用eculizumab的PNH和贫血患者,eculizumab是一种先前被批准用于PNH的治疗方法。患者首先完成为期四周的疗程,在此期间,除了先前剂量的eculizumab外,以及加入每周两次Empaveli(1080mg)。前四周后,患者被随机分配接受Empaveli或eculizumab治疗16周。
16周后,根据血红蛋白浓度(贫血的实验室指标)比较两个治疗组的贫血严重程度。在两个治疗组中,基线时的平均血红蛋白为8.7g/dL,表明贫血严重(成年男性的正常血红蛋白值为14g/dL或以上;成年女性的正常值为12g/dL或以上。)在16周的治疗期间,Empaveli组患者的血红蛋白平均增加了2.4g/dL。同时,eculizumab组患者的血红蛋白平均下降了1.5g/dL。
Empaveli注意事项:脑膜炎球菌(一种细菌)感染可发生在服用恩帕韦利的患者中,如果不及早治疗,可能会危及生命或致命。Empaveli也可能使个体易受严重感染,特别是由包裹细菌引起的感染。应监测患者的输液相关反应。Empaveli可以干扰某些实验室测试。最常见的副作用是注射部位反应、感染、腹泻、腹痛、呼吸道感染、病毒感染和疲劳。
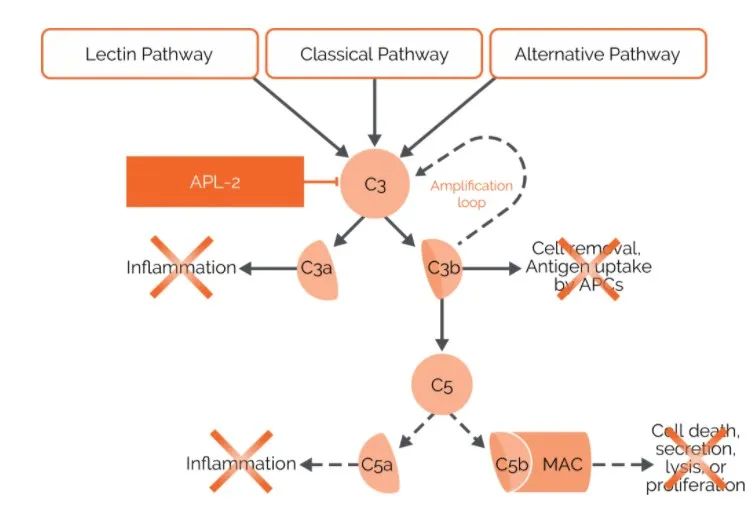
Pegcetacoplan(APL-2)
Empaveli的活性药物成分为pegcetacoplan,这是一种靶向性C3抑制剂,旨在调节补体级联(机体免疫系统的一部分)的过度激活,补体级联可导致许多严重疾病的发生和发展。Pegcetacoplan是一种人工合成的环肽,与聚乙二醇聚合物结合,与C3和C3b特异结合。 Apellis正在血液学、眼科学、肾病学和神经学的几项临床研究中评估Pegcetacoplan。Pegcetacoplan已被美国食品和药物管理局(FDA)授予治疗阵发性夜间血红蛋白尿(PNH)和治疗地图样萎缩(GA)的快速通道指定,并被FDA和欧洲药物管理局授予治疗C3G的孤儿药物指定。
关于阵发性夜间血红蛋白尿症(PNH)
PNH是一种罕见的、慢性的、危及生命的血液疾病,其特征是通过血管外和血管内溶血破坏携带氧气的红细胞。持续低血红蛋白可导致频繁输血和虚弱症状,如严重疲劳、血红蛋白尿和呼吸困难(呼吸困难)。回顾性分析显示,即使使用eculizumab,约72%的PNH患者也有贫血,这是持续溶血的一个关键指标。1分析还发现,36%的患者每年需要输血一次或多次,16%的患者需要输血三次或三次以上。
Apellis和Sobi的合作
Apellis和Sobi于2020年10月开始合作开发pegcetacoplan及其商业化。双方拥有pegcetacoplan的全球共同开发权。Sobi拥有pegcetacoplan在美国以外的独家商业化权利,Apellis拥有pegcetacoplan在美国的独家商业化权利,并保留全球眼科pegcetacoplan的商业化权利,包括地图样萎缩(GA)。
Apellis
Apellis是一家全球性的生物制药公司,致力于利用科学、创造力和同情心来提供改变生活的疗法。作为C3靶向治疗的领导者,目标是开发一系列由补体级联过度激活引起的衰弱性疾病的转化性治疗,包括血液学、眼科和肾病。



 个人中心
个人中心
 我是园区
我是园区




