 本文内容来自FDA专家报告,关于细胞/基因治疗产品的CMC挑战,包括研发和生产过程。
本文内容来自FDA专家报告,关于细胞/基因治疗产品的CMC挑战,包括研发和生产过程。
01

细胞和基因治疗(CGT)产品的多样性

02

CGT产品涵盖广泛,每个产品都有自己的关注点

03

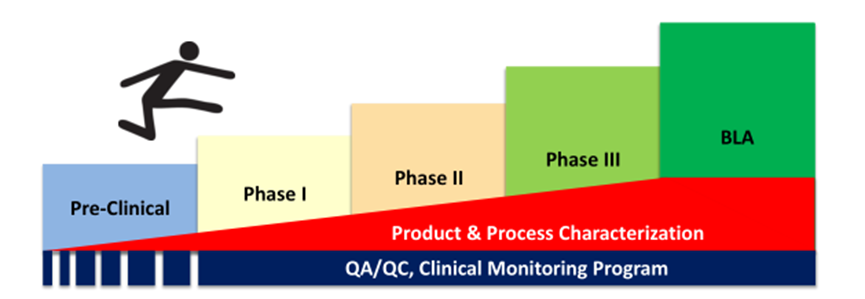
产品开发的生命周期方法
随着临床的发展,产品质量不断得到保证
☉ 实现完整的cGMP
☉ 工艺、分析鉴定、验证
☉ 建立适当的放行标准

04

加速开发CGT产品面临的CMC挑战
☉ 有限的制造经验:
生产的批次不多
多轮工艺变更
☉ 有限的工艺测试:
工艺变量和关键工艺参数(CPP)未知
☉ 有限的产品特征:
关键质量属性(CQA)未知
有限的产品和工艺相关杂质知识
☉ 有限的分析开发(效力、纯度)
☉ 收集的有限产品稳定性数据
05

CGT产品制造是复杂的

06

制造业变革是不可避免的
• 应对制造问题或污染问题
• 试剂或材料不再可用或供应不足
• 细胞库已过期或耗尽
• 根据新的科学或临床信息提高产品质量
• 转向更现代化、更高效或更精简的流程
• 降低成本
• 产品生命周期的任何时间点都可能发生变化,但需要确保变更不会对产品质量产生负面影响

07

CGT产品开发期间可能发生的变化
• 试剂、原料、组分、制造设备
• 制造工艺
改变悬浮培养物
改变刺激方法
改变纯化程序
• 制造规模
• 制造场所
• 配方
缓冲液(冷冻保存、冻干)
浓度
•改变分析测试程序
08

产品可比性
•当对生产工艺进行变更时,申办方通常会评估产品的相关质量属性,以保证变更不会对药品的安全性和有效性产生不利影响的。
•如果制造商能够通过分析研究提供可比性保证,则产品可比性的确定可以仅基于质量考虑。当质量数据不足以建立可比性时,非临床或临床研究的额外证据是可以考虑的。
09

分析可比性研究考虑
• 进行风险评估,评估变更的影响
• 评估与产品质量和安全相关的属性,以及最有可能受变更影响的属性
• 用适当、稳健的统计方法,为评估的每个属性的可比性预先定义验收标准
• 建议在启动BLA的临床研究之前进行变更
☉ 如果在开发后期引入变更,可比性研究的难度将显著提高
☉ 如果分析可比性研究数据不足以建立可比性,可能需要额外的临床前和/或临床研究来证明可比的安全性和有效性。

10

建立CGT产品可比性的挑战
•有限的制造经验:
-生产的批次不多
-没有足够的保留或测试样本可用
•有限的过程中测试:工艺变量和CPP未知
•有限的产品特性:CQA未知,产品和工艺相关杂质未得到很好的表征
•有限的分析开发(例如纯度、效力)
-分析不合格或不稳定
-未建立或充分表征参考标准
11

CQA和CPP一起使用,以帮助确保质量和制造一致性

12

CGT产品CQA
• 在早期开发过程中探索
-在开发早期报告结果
-为后期研究选择相关测试
• 评估CQI的多种方式
-分析矩阵
-正交方法
-稳定性指示

13

CGT产品测试的矩阵方法

14

分析开发时间表



15

CGT产品发布规范的常见问题
•未捕获关键产品属性(关键质量属性)规范
•与制造经验不一致的标准
•缺乏支持性数据或基本原理
•仅测量想要的,而不是不想要的
•为非常广泛的范围设置的标准
-可能会增加临床试验的可变性
-可能会使鉴定分析和工艺更加困难
•对数据的曲解或过度解释
16

产品可变性的影响

17

效力分析挑战
•作用模式可能不完全清楚
•释放试验的时间限制
•可供试验的材料有限
•参考标准品和对照品的可用性有限
•基于细胞的分析可能高度多变
18

分析测试的变化
•分析方法的变化-评估分析的差异(输出、灵敏度、参考材料等)
•分析转移或添加测试点-证明结果在不同点之间具有可比性
•在测定结果之间建立可比性/相关性
•也可能影响稳定性研究

19

稳定性测试
•仔细评估原料药和药品中成分(残留物、赋形剂等)的干扰。
•包括稳定性指示分析
•使用新的敏感技术来表征在应激/加速条件下储存的CGT产品
•设备兼容性研究
-应包括产品强度、含量和效力的测量
-收集用于临床的产品剂量、设备和条件等数据

20

小结
• 临床评估的CGT产品数量达到了历史最高水平
• CGT产品是复杂的生物制品,需要对生命周期管理进行预先考虑,尤其是那些处于加速开发中的产品。
• 产品和工艺表征和分析开发应尽早开始,并在整个产品生命周期中持续进行
☉ 以开发稳健的制造流程
☉ 识别产品CPP和CQA
☉ 以帮助建立产品可比性。
• 在CGT产品的生命周期中,预计会出现工艺和分析测试变更
☉ 提前计划,尝试在产品开发早期解决潜在的CMC问题
☉ 必要时,进行全面、精心设计的可比性研究
参考文献
https://www.casss.org/detail-pages/resource/cmc-challenges-during-accelerated-development-of-human-cell-gene-therapy-products---a-cber-perspective




 个人中心
个人中心
 我是园区
我是园区




