速递!嘉和生物CD20/CD3双特异性抗体获批1/2期临床
收藏
关键词:
临床期临床获批抗体生物
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-05-25
5月24日,嘉和生物宣布,其CD20/CD3双特异性抗体GB261获得中国国家药品监督管理局(NMPA)1/2期临床试验默示许可,拟用于复发或难治性B细胞非霍奇金淋巴瘤(B-NHL)和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者的治疗。
在海外,GB261已经在澳大利亚达成首次人体临床试验(FIH)的首位患者给药。
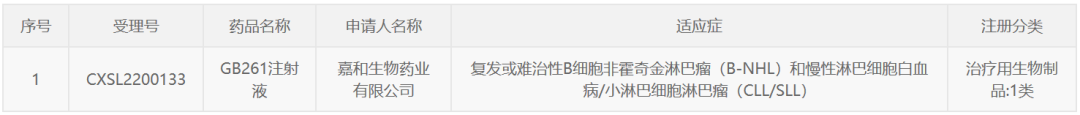
公开资料显示,GB261由AB Studio公司高低双抗平台设计并由嘉和生物进一步开发,是一个与CD3低亲和力结合并保持Fc功能(ADCC和CDC)的T细胞接合器(T Cell Engager)。
根据嘉和生物早前新闻稿介绍,作为一款具有显著差异化并极具治疗潜力的双特异性抗体,GB261弱化了与CD3的亲和力,同时保留了IgG1 Fc效应功能。
体内外结果均显示,GB261能够有效地激活T细胞,抑制CD20阳性的肿瘤细胞增殖,并减少细胞因子分泌。
另外,GB261通过体外测定和体内模型显示能够显著抑制rituximab耐药癌细胞的增长。
2021年8月,嘉和生物宣布GB261在澳大利亚开展的首次人体临床试验实现首位患者入组,该试验针对适应症为B-NHL。本次该产品在中国获批1/2期临床,拟开发适应症包括B-NHL和CLL/SLL,它们均属于非霍奇金淋巴瘤。
非霍奇金淋巴瘤(NHL)是一类起源于淋巴结和其他淋巴组织的恶性血液肿瘤,常见于B细胞。NHL患者虽然对最初的治疗反应良好,但是他们的病情通常伴随着多次复发,每次复发之后的缓解期越来越短。晚期NHL患者通常需要全身性的化学免疫治疗,他们急需新的有效疗法来缓解疾病进展,延长生命。
希望嘉和生物CD20/CD3双特异性抗体GB261在临床研究中进展顺利,早日为更多淋巴瘤患者带来新的治疗选择。
[1]嘉和生物宣布GB261获得I/II期临床试验批准. Retrieved May 24,2022, from https://mp.weixin.qq.com/s/wSqmJHFZlBMzn8THcNAdNA
[2]嘉和生物GB261首次人体临床试验在澳洲实现首位淋巴瘤患者入组. Retrieved Sep 1,2021, from https://mp.weixin.qq.com/s/6X-oBczYlDl0b8UptGQeNQ
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。




 药选址
药选址

