Current Biology | 赖仞团队牵头揭示有毒动物如何妥善管理毒素“武器库”
收藏
关键词:
揭示
资讯来源:BioArt + 订阅账号
发布时间:
2022-07-23

产毒动物的毒液腺起源于某些器官的特化,譬如蜈蚣的第一对步足,蝎子的最末体节,蜘蛛的口器等。这些毒腺被用于分泌和储存毒液。当毒液注入猎物、天敌或竞争者的体内,毒素通过靶向相应受体高效地实施捕食和防御等生理生态学功能。中国科学院昆明动物研究所赖仞研究员领导的研究团队长期关注有毒动物生存适应策略及其物质基础和生态生理学机制,阐明了多种产毒动物毒液中参与捕食
【1-4】
、防御
【5-7】
以及种内竞争
【8】
等生态学功能的关键毒素成分及机制,并在此基础上发展毒伤快速诊断方法和救治手段。
有毒动物必须妥善管理其毒液中的具有极高生物活性的毒素,以防止自我中毒。在分子层面上,有两种阻断自我中毒策略:第一种策略是利用“海绵”分子预先结合毒素,从而使其不能与自身受体互作
【9】
。这种策略以降低毒素分子对潜在“敌人”的毒性和中毒效率为代价。第二种策略则是对自身受体进行修饰,使得毒素无法与自身受体结合
【8】
。但毒素靶向的受体往往执行重要的生理功能,修饰自身受体很可能导致自身生理功能的严重受损。可见,毒素这把双刃剑一方面为有毒动物的生存提供了威力巨大的武器装备,但又对产毒动物安全管理这些“化学武器”提出了极高要求。那么产毒动物能否可以安全管理好自身毒液武器库,以杜绝这些毒素分子影响自身生理功能呢?
2022年7月20日,中国科学院昆明动物研究所的赖仞课题组联合东北林业大学杨仕隆课题组在Current Biology上发表了题为
Venom resistance mechanisms in centipede show tissue specificity
的研究论文,该研究揭示:
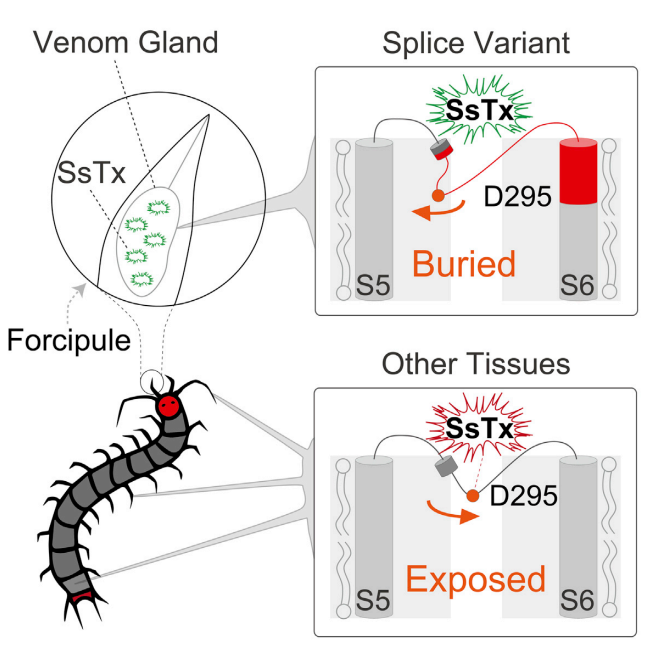
在蜈蚣毒腺组织特异性的可变剪切可以使自身受体的突变只发生在毒腺中,而其他不接触毒素的器官则不需要突变,该策略极大降低了完成毒素自我耐受所需承担的功能代价。
在该工作中,研究人员以广泛分布于中国的少棘蜈蚣作为研究对象,探索毒素自我耐受机理。值得注意的是,SsTx是蜈蚣用于捕食的关键毒素多肽,它靶向猎物的钾离子通道KCNQ家族使猎物快速中毒
【2】
。因此,蜈蚣自身KCNQ通道完成对SsTx的耐受至关重要。研究人员发现KCNQ1在蜈蚣毒腺中高表达,但这些KCNQ1的信使RNA
(mRNA)
序列与蜈蚣其他组织中的mRNA存在差异。这是由于蜈蚣毒腺中KCNQ1基因采用了一种特有的剪切模式。在毒腺组织中,KCNQ1钾离子通道的孔区和跨膜区S6的部分序列由KCNQ1基因的外显子6编码,而在其他组织中,该区域则是由KCNQ1基因的外显子7编码。这种组织特异性的剪切模式形成了毒腺特有的KCNQ1钾离子通道,其蛋白序列与正常KCNQ1存在11个氨基酸差异;在功能上,其对自身毒素高度耐受,从而在这一毒液分泌和储存的重要器官中建立了一个自我毒素耐受的安全特区
(图1)
。
该机制有效规避了在全身受体蛋白中引入突变所带来的生理功能风险,有针对性地在毒腺组织特异性地进行受体结构功能调整以实现对自我毒素的耐受,这可能是毒素在进化中进行结构功能优化的重要保障机制。
中国科学院昆明动物研究所赖仞研究员和东北林业大学杨仕隆教授为该论文的共同通讯作者,东北林业大学王云飞副教授、博士研究生尹传玲和中国科学院昆明动物研究所博士研究生张浩为共同第一作者。
https://doi.org/10.1016/j.cub.2022.06.074
制版人:十一
1. S. Yang et al., Chemical punch packed in venoms makes centipedes excellent predators. Molecular & cellular proteomics : MCP 11, 640-650 (2012).
2. L. Luo et al., Centipedes subdue giant prey by blocking KCNQ channels. Proceedings of the National Academy of Sciences of the United States of America 115, 1646-1651 (2018).
3. C. Du et al., Centipede KCNQ Inhibitor SsTx Also Targets K(V)1.3. Toxins 11, (2019).
4. B. Li et al., Molecular game theory for a toxin-dominant food chain model. National science review 6, 1191-1200 (2019).
5. M. A. Hakim et al., Scorpion Toxin, BmP01, Induces Pain by Targeting TRPV1 Channel. Toxins 7, 3671-3687 (2015).
6. S. Yang et al., A pain-inducing centipede toxin targets the heat activation machinery of nociceptor TRPV1. Nature communications 6, 8297 (2015).
7. S. Yang et al., A bimodal activation mechanism underlies scorpion toxin-induced pain. Science advances 3, e1700810 (2017).
8. S. Yang et al., Target switch of centipede toxins for antagonistic switch. Science advances 6, eabb5734 (2020).
9. F. Abderemane-Ali et al., Evidence that toxin resistance in poison birds and frogs is not rooted in sodium channel mutations and may rely on "toxin sponge" proteins. The Journal of general physiology 153, (2021).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 药选址
药选址



