深度 | 谢雨礼:生物医药新技术的发展趋势
收藏
关键词:
生物医药生物药医药新技术
资讯来源:药时代 + 订阅账号
发布时间:
2022-09-02

导读
“物理学家开始‘杀入’到生物医药的创业浪潮中来”、“从0到1的创新相对困难,适合当前中国的企业做创新”、“与美国相比,特别是在前沿的、革命性的领域,我们还存在很大的差距”。
8月21日,在“深究科学”与浙江大学基础医学创新研究院等单位联合主办的“源创论坛”上,知名药物开发专家、微境生物创始人谢雨礼博士如上表示。
他深入解读小分子、大分子、细胞治疗、基因疗法等不同热门技术,并总结了它们的优缺点以及未来的发展趋势。
当前国内生物医药受到疫情以及大环境的影响处于低谷,但对新技术以及创新的需求,我们从未放缓。哪些新技术未来能引领潮流,生物医药创新有哪些新趋势?本文做了很好的总结。(注:上一篇文章为报告的上半篇,本文为全部的分享内容)
药物研发说复杂也复杂,说简单也很简单,其实就是两部分:一是理解疾病发生发展背后的生物学机制,二是找到干预这个机制的手段。药物便是其中一个最重要的干预手段。
现代药物发现还是基于靶点,也就是分子生物学主导的药物发现,然而整个生物学的范围非常广,每年都有各种各样新的靶点出现,或者是科学家发现了一些老蛋白的新功能。每年CNS文章会报道许多具有转化价值的生物学研究。
这方面今天我不涉及,我主要想跟大家分享这两年整个生物学领域新的变化趋势,比如从物理学的视角关注生物学。
从物理学的视角关注生物学,来开发药物
几十年来,我们研究得最多的还是生物大分子的化学反应,或者生物大分子之间的相互作用。很少以物理视角看生物学,但近两年有了一些新变化——随着各种技术的发展,比如说光和图像的技术发展,很多基础研究开始从物理学视角看待生物学。
去年,前默沙东首席科学官(CSO)Roger Perlmutter博士与美国贝尔实验室的一位发明荧光显微镜的诺贝尔奖获得者Eric Betzig教授合作,创立了一家公司Eikon,通过荧光显微镜观察活细胞状态下蛋白的运动轨迹,即细胞内部蛋白的时空变化,以此来观察正常和病理性状态下的蛋白运动轨迹有何不同。
Eikon公司表示,目前他们不着急做药,先观察3-5年,形成大数据后通过人工智能分析蛋白运动轨迹,再从中找出规律,找到一种全新的、与现在制药角度完全不同的方法,进而找到一些革命性的药物。
很显然,这家公司的理念、方法以及所做的相关研究都是非常前沿的,两位创始人的影响力很大,以至于目前他们什么都还没做出来就已经融资超过5亿美元,所以我们可以看到,美国的一些公司正在做一些非常前沿的事情。
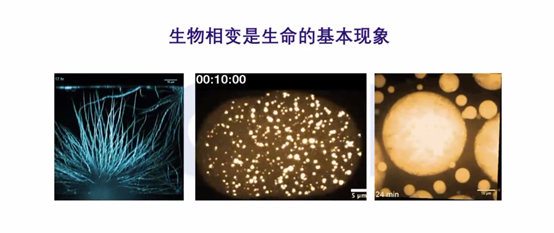
生物相变,一个逐渐火热起来的赛道
值得一提的是,在物理学视角下的生物学研究中,有一个领域发展非常快——生物相变(或相分离/生物凝聚体)。
细胞里面有一个现象——蛋白或者生命分子,会发生一个类似油水分离的现象。早在100多年前,就有人注意到,细胞核里面的核仁就是一个没有细胞膜的小液滴,这就是生物相变现象。后来,研究者又相继在细胞中发现了很多类似的小液滴。
但直到最近,这一现象变得特别热门,随着一些技术的发展,研究者开始重新审视以前生物学中的一些发现。
从生物相变角度来看,不仅几乎所有的基本生命现象都与之有关,疾病的发生发展也与其高度相关,如DNA修复,肿瘤中常见的KRAS、mTOR信号通路,以及老年痴呆症等,基本上都有生物相变的参与。
生物相变在促进生物学发展的同时,也为医药行业的发展提供了新的契机。生物相变公司起步于欧美,第一家生物相变公司Dewpoint于2019年成立。这两年基于生物相变的公司都融到了几千万美金以上的大额投资,它们的药物都没有上临床试验,还都处于非常早期的状态。
虽然我国生物医药产业近年获得了大跨步的发展,在制新药方面也取得了一些成果,但与美国相比,特别是在前沿的、革命性的领域,还存在很大的差距,就拿这些生物相变公司来说,它们刚成立的时候,我们都不知道它们在干什么,对它们的靶点和制药方式更是一无所知。
具体来说。2020年,Dewpoint公司的科研人员在《科学》杂志上发文,研究了乳腺癌的雌激素受体调节剂,即他莫西芬这一传统乳腺癌药物的耐药机制,在此之前,我们对该药的耐药机制了解甚少。一般的耐药都是靶点突变,但他莫西芬的耐药机制未发现靶点上的突变,这篇论文发现,雌激素信号传导需要生物相变参与,即整个雌激素上游及下游的蛋白会形成一个小液滴,这个小液滴中会发生各种各样的化学反应
生命其实就是生物分子的化学反应,随着小液滴浓度的升高,它的信号会加快,信号完成以后,小液滴就会自己消失。所以当他莫西芬作用于雌激素时,需要进入小液滴才能够阻断信号通道的传导,而当它产生耐药时,肿瘤细胞会把小液滴的体积变大,就像吹气球一样把它“吹大”,在同等剂量下,药物相当于被稀释了,它的相对浓度不够了,这便是他莫西芬的耐药机制。
如果没有生物相分离,我们根本想都想不到,也谈不上做药,有了这样的发现,我们就知道怎样去筛选能够在小液滴富集的化学药物。
此前我们做药的时候需要做DMPK的研究,包括研究药物在各个组织当中的分布,今后我们要研究单细胞层面上药物在各个亚结构间的分布。因此,生物相变技术可以说拓展了药物发现深度,并且为生物医药的发展带来一些前所未有的机会。
事实上,生物相变在欧美已经是热门的赛道,我们还看到一个比较有趣的现象:在这些生物技术公司中,几乎一半以上的公司创始人是物理学教授,也就是说,物理学教授在生物医药领域创业已经成为热门。国内在这方面的研究也在起步,第一个公开报道是朱继东教授跟罗氏的合作。
当然这个赛道还非常早期,甚至还没有药物上临床,能不能做成药以及什么时候能做成,还是一个未知数,但无论是投资者还是创业者都在密切关注这个领域的进展。
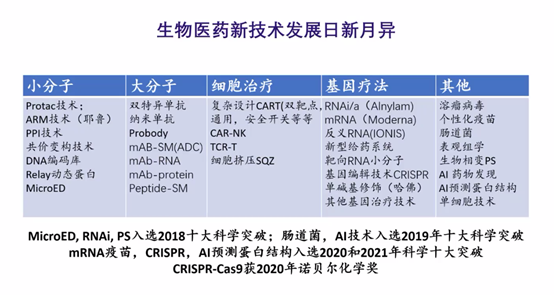
日新月异的生物医药新技术
接下来,我来介绍技术手段,即怎样来干预各种生命活动的技术手段。上面是我做的图表,总结了小分子、大分子、细胞治疗、基因疗法等不同领域内的热门技术。
实际上,做生物医药无论是投资、立项,或者是做学术研究、开辟一个新的方向,其中一个很重要的点是:要有前瞻性。这是因为这个行业周期非常长,一般是十年才能做成一个药。我们不能看当下什么热门就做什么。
虽说需要有前瞻性,但前瞻性非常难,如果我们脑子里没有准备的话,就算别人在耳边说也没有用。例如,PD-1抗体,2012年陈列平教授回国说这种药物的潜在价值,2014年《科学》杂志将其列为10大科学突破之首,但直到2014年信达、君实才开始做PD-1药物的开发。
做得早或许就会成为几百亿的公司,但如果现在再去做PD-1药物,可能就要亏本,因此前瞻性很重要,但也很难。
那么,该怎么提升对于前瞻性的敏感度?通过关注基础研究领域的论文以及关注《科学》杂志每年的评选的10大进展和《自然》杂志评选的前沿技术进展,还是可以帮助我们提前1-2年看到技术发展的趋势。
接下来,我总结下各种药物形式的特点。各种药物形式都有自己的特点,不同的药物形式之间可以互补,不存在谁淘汰谁的问题,这里按照不同的药物形式,总结了小分子、大分子、细胞治疗、基因疗法等不同领域内的热门技术。
当前生物医药新技术发展日新月异,但其中并非无规律可循,也可以总结出其中的几点发展趋势:
简单来说,就是通过模拟大自然设计好的调控方式进行药物干预,比如传统小分子当中的共价抑制剂,以前不鼓励做共价抑制剂,因为觉得它没有选择性、有毒性,但最近的情况有所变化,至少在肿瘤领域,一半的小分子可能都在做共价抑制剂。
历史上最成功的这类药物,几乎都是共价抑制剂,如阿司匹林、青霉素,化药里面排第一的氯吡格雷以及最近几年上市的奥希替尼等。因此,模拟共价反应的共价抑制剂成为小分子药物开发非常重要的一个方向。
再举一个例子—KRAS靶点,以前认为它属于“不可成药”的靶点,就像是一个没有“口袋”的光溜溜的球,很难用传统的小分子做,但现在通过共价反应,研究者可以在它身上诱导出一个“口袋”,这就打开了药物创新的大门。
除此之外还有很多“不可成药”的靶点,都有可能通过共价的技术去调控,因此这也是极具标志性意义的一项突破。
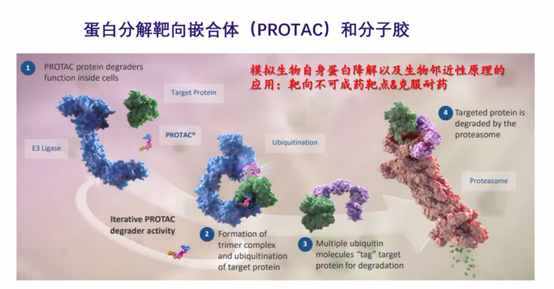
再举一个大家可能都知道的例子—PROTAC,这其实也是模拟人体的一个调控。人体其实是一个多层次的调控,比如说一个蛋白,它既可以让你的基因不表达,产生变异,也可以让mRNA降解,即便是表达成蛋白以后,还可以把它降解掉。传统的小分子药物,主要是抑制蛋白的功能,比如各种酶的抑制剂。人体中有各种各样的蛋白降解系统,其中最重要的一个降解系统被称为泛素化系统,而PROTAC技术就是模拟泛素化系统降解蛋白的过程,它主要分为三部分:一部分跟要降解的蛋白结合;另一部分跟一个泛素化系统的E3连接酶结合,以及将两者结合起来的连接子(Linker),这就是PROTAC模拟蛋白降解的过程。
这一过程中其实利用了生物学中很重要的生物邻近性原则,即把两个体系里面的两个分子拉在一起,它们就会产生生物学效应。比如PROTAC技术,即把要降解的蛋白跟E3连接体通过一个分子拉在一起,然后启动泛素化降解。
最近,提出PROTAC的领头公司Arvinas在临床上取得了一些初步的数据,比如至少能把靶点降解掉,我们也能看到一些简单的疗效了,所以整个赛道非常热门,不管是学术界还是工业界都在做。
这里我想给大家分享一个创新思维的问题,国内做PROTAC技术应用,还是一种fast follow或者是一种微创新的方式,避免了一些大的风险,而西方更加讲究科学的思维:归纳,然后再进行演绎。比如说PROTAC技术可用来降解蛋白,但是不是还有其他降解蛋白的方法,比如自噬、伴侣蛋白。从蛋白降解出发,欧美做了很多新颖的降解技术,这跟中国大多数做的PROTAC还是有很大的差异。
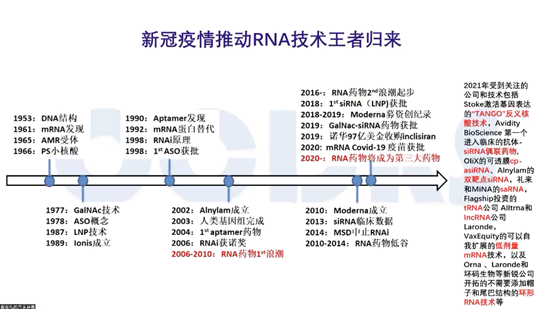
所谓的程序化制药并不是个新概念,早在2003年左右,小核酸第一个高潮时,大家就已经提出来了。
那么,什么叫程序化制药呢?药物的设计就像计算机编程一样。以核酸药物为例,根据碱基配对规律,即一个什么样基因对应一个什么样的序列,来设计小核酸和反义核酸,设计上非常程序化,这就是程序化制药。
此前由于临床结果不好,这一领域的热度有所减退,但最近因为递送技术的成熟,小核酸又重新恢复了热度,Flagship的创始人对程序化制药感兴趣,把这一概念重新提出来,程序化制药也包括基因疗法。
比较经典的基因疗法是指基因通过AAV把基因传导进人体,从而表达某个蛋白,但现在的基因疗法范围更大,包括比如说小核酸、基因编辑等都属于广义的基因疗法。基因疗法从2018年就开始备受关注,新冠mRNA疫苗出现后,把它炒到了一个非常顶峰的状态。
上面我总结了核酸药物的发展历程,小核酸领域经历了几起几落。任何一个新技术都是这样的,不可能是一蹴而就,这两年小核酸领域又涌现了许多新的技术,如环码RNA、tRNA、非编码RNA等。
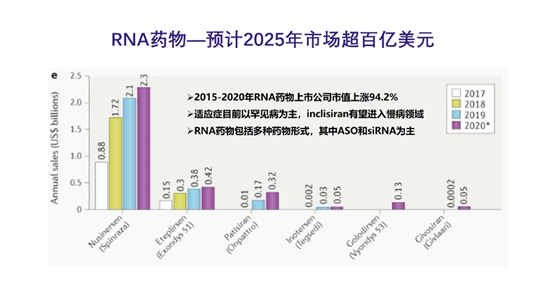
相比其他新技术来说,我觉得核酸药物发展会更快,因为它更像传统的药物,小核酸其实就是化学药物,可以通过化学合成。目前,全球在研的核酸项目可能超过几百个(不包括在研的新冠疫苗项目)。预计到2025年,这类药物销售额会超过百亿美元。
所以,我觉得它很快就会成为继小分子、单抗之后第三大药物类型,发展会比细胞、基因编辑领域更快一些。
mRNA技术大家可能都因为新冠疫苗的崛起听说过。我们一句话概括:就是蛋白替代,所有蛋白药物理论上都可以被mRNA替代。mRNA可以替代单抗,也可以应用于再生医学,因为很多转录因子也是蛋白分子,而且这类药物不需要GMP车间,直接将小剂量的mRNA打到人体,就可以自行表达,相当于把蛋白工厂搬到人体中去了。
但它也有短板,当它作为疫苗,只要少量mRNA即可激起人体免疫反应,而作为治疗性蛋白时则不一样,它需要在正确的地方,表达正确的蛋白,还需要正确地修饰,这样难得多,所以mRNA技术针对于治疗蛋白,并没有实质性的突破。
程序化制药还有可能实现真正的药物定制,它的设计相对简单,可以针对某一个病人给你开发一款药物。对于传统药物来说,这是几乎不可能的,但核酸这样的新技术就可以做到。
事实上,美国FDA历史上第一次批准了为一个病人研发的药物,FDA两位高管还在杂志上撰写了评论:假设当这样的单病人时代来临,我们监管怎么办?
文章阐述了病患和医生将成为合作关系。药物的安全性、有效性和临床统计性的意义将不复存在。产品质量控制谁说了算、如何支付等一系列问题显示:单病人时代会使整个监管模式发生改变。
当然目前这个技术还是非常早期,我认为随着新技术的发展,十年之内都是有可能大规模实现药物定制。
核酸药物中还涉及到了基因编辑技术。其中CRISPR/Cas9技术于2020年获得了诺贝尔奖,也是基因编辑技术中最经典的一个,许多技术都是从这里延续起来的。
目前,它在临床上也已有了一些可见的概念验证数据,因此拥有很高的估价。张锋、David Liu等基因编辑界的“大牛”创立的基因编辑公司,也已在纳斯达克上市,因此基因编辑在投资和创业方面都是十分热门的领域。
药物形式的互换、组合和升级
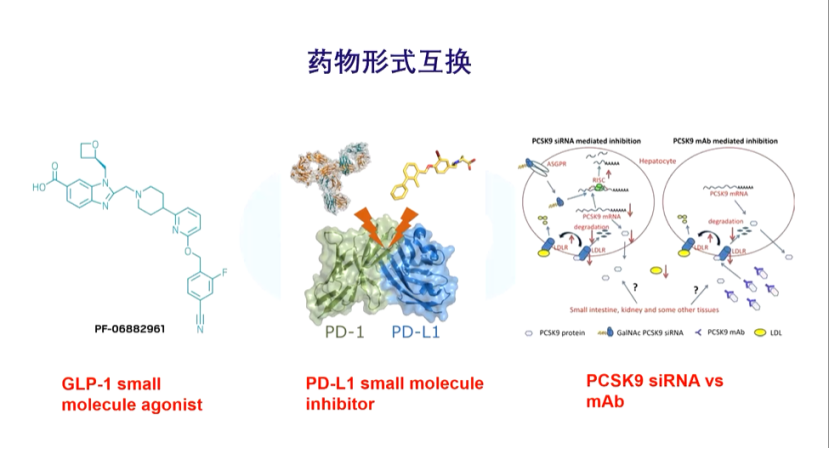
药物技术的发展一个新趋势就是药物形式的互换、组合和升级。药物形式的互换可以在各种各样的药物形式间进行,如小分子、单抗、siRNA,以及比较受关注的基因编辑。药物形式的互换可能会产生不同的生物性效果。
在肿瘤药物的开发过程中,两种不同的互换机制甚至可以联用,达到克服耐药性的效果。比如,HER2的小分子抑制剂跟HER2单抗联用。这是一个性价比较高的技术创新方向。
除此以外,不同药物形式之间还可以进行组合创新。组合创新是指通过对多个单一技术进行组合,从而探索它涌现的新性质。
这个方向特别适合中国的企业做创新,因为目前做从0到1的创新相对困难,而组合创新的优势是,它的单一技术一般都已经在公共领域公开发表,不会受到专利限制,性价比也会相对较高。
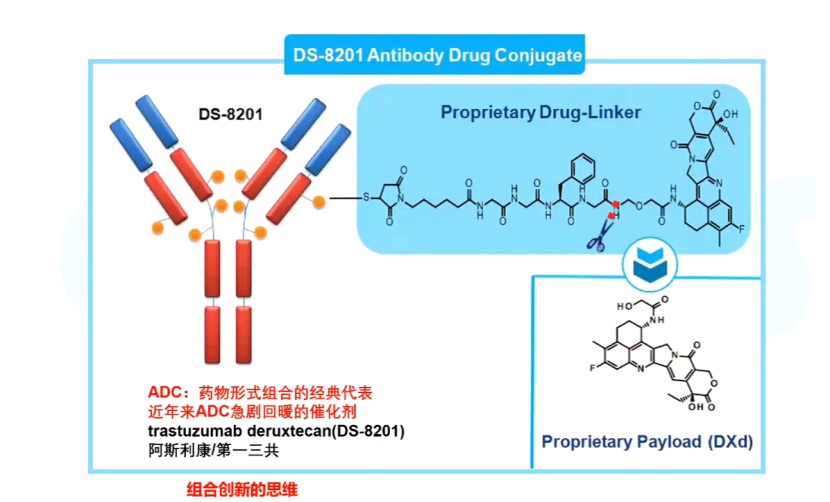
一个很经典的例子就是最近比较受关注的DS-8201,它是一个靶向HER2的抗体偶联(ADC)药物,最近,取得了巨大的成功,它在实体瘤效果不错,在乳腺癌、非小细胞肺癌疗法都已经获得了批准,尤其针对HER2中低表达的乳腺癌效果很好。
DS-8201的结构是什么?上图显示,它的ADC分为三部分:单抗、连接子和小分子毒素。这三样都是早就存在的东西,第一三共通过十几年的打磨,经过了不断的优化组合,最终做出了这样一个极具革命性的药物。
从这个例子可以看出,许多时候药物的创新是技术科学的创新,这和基础研究之间有一定的区别。关于DS-8201的文章仅发表在一些影响因子较低的小杂志上,并非高大上的《细胞》(Cell)和《自然》(Nature),但这并不妨碍其成为一个革命性药物。
技术科学非常琐碎,也没有什么理论指导,需要不断打磨和尝试,需要耐心和工匠精神,所以我经常开玩笑说,DS-8201也只有日本人能做得出来。这一点值得我们很多创新者和生物医药企业学习。
有时候我们会说中国的原创不行、基础研究不行,其实也不一定,像DS-8201技术的研发就不需要什么基础的原始创新,近些年批准的很多原创药物,也并不是做基础研究所得到的。
虽然说基础研究对于整个生物医药领域非常重要,但是对于具体企业来说,未必是必需的。我们要把创新和基础研究的关系,以及科学与技术的关系理清楚,才能有的放矢地做适合我们的创新。
另一个组合创新的例子,是双特异性抗体。目前,单抗已经是一个相对成熟的技术,,但是单抗药物有一个局限性,它是一个生物大分子,无法穿透细胞膜,一般只能作用于细胞膜表面的受体,这就导致了它所面临的瓶颈:缺乏靶点、同质化竞争十分激烈,想要解决优质靶点太少的问题,就需要进行靶点的组合创新,比如说做成双抗和多抗。
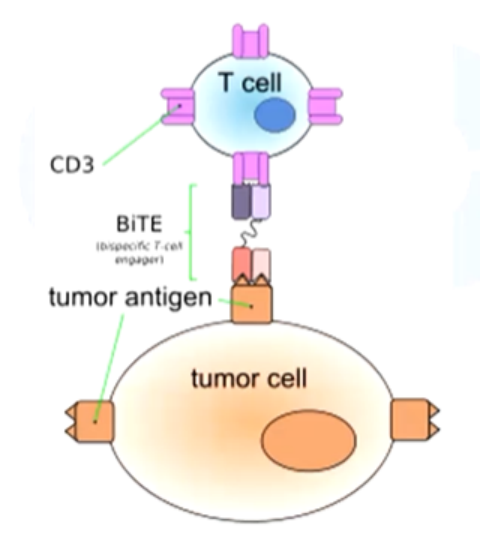
经典的双抗实际上是一个细胞结合器,类似于分子胶,将两种细胞拉在一起。比如把T细胞跟肿瘤细胞拉在一起,让T细胞把肿瘤细胞“干掉”,经典的双抗就是基因泰克的BiTE抗体药物。
当然现在双抗的概念已经有所扩展。对于任何含有两个结合位点的分子,比如结合在同一个细胞上两个不同的靶点,甚至同一个靶点不同的表位,我们都将其称作双抗。双抗也会产生一些新的性质,也就是我们所说的“More is different”。
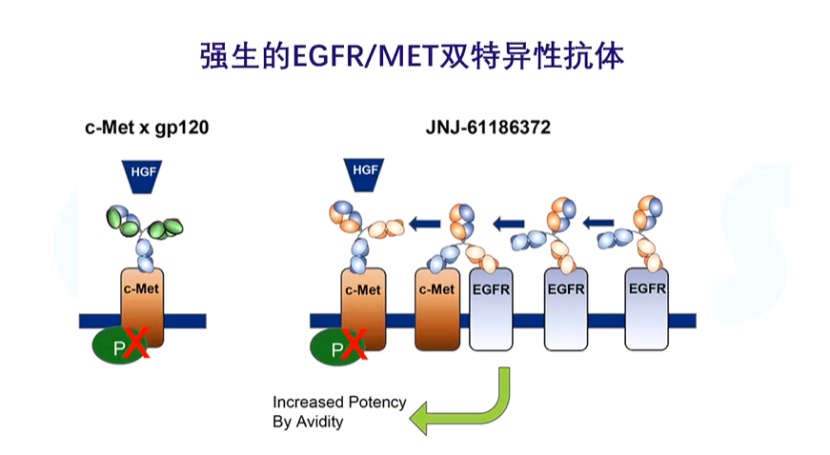
双抗技术现在特别火,去年批准的强生EGFR/MET双抗就是一个特别有名的明星分子。其实它的设计非常简单,EGFR变异是一个非小细胞肺癌的驱动基因,MET扩增也是,将它靶向两个靶点,就可以增加疗效,克服耐药。
EGFR/MET双抗技术与两个单抗联用有什么不同之处?事实上,将两个抗体做在同一个分子里会涌现许多新的性质,以EGFR/MET为例,EGFR和MET的亲和力存在差别,EGFR亲和力弱,MET亲和力更强,是EGFR的40倍,二者联用的好处在于,在正常组织内,MET表达比较低,此时它单独作用的效果相当于EGRF单抗,结合力比较弱,副作用就会比较小,但是到了肿瘤细胞内,MET就会高度表达,此时的效果相当于ADC,把分子拉到肿瘤细胞的附近。
但这还不是最重要的,EGFR/MET双抗还有一个被称为ACDT的免疫效果,也就是说它可以与巨噬细胞相结合,发生胞啃作用,将肿瘤细胞的c-MET和EGFR吸到巨噬细胞里去。这有时候是两个单抗联用所不能达到的,恰恰非小细胞肺癌的巨噬细胞数量是最多的。因此,双抗的各种特点组合在一起,才使它成为了一个非常成功的药物。双抗涌现出的性质决定了它的成功,这为我们做双抗研究提供了一个很好的案例。
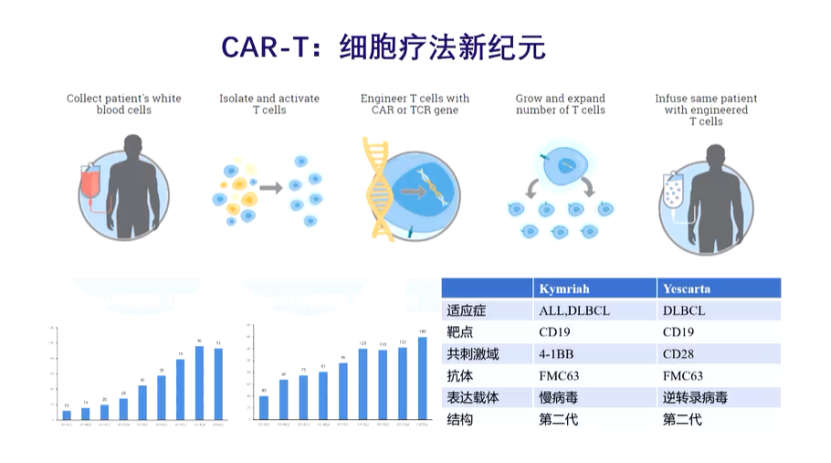
除此以外,更复杂的组合平台就是细胞了。细胞就像航空母舰一样,像现在大家关注比较多的多能干细胞(iPSC)以及大家耳熟能详的CAR-T治疗。
CAR-T即T细胞通过基因编辑装上一个“雷达”,也就是抗体,将抗体和T细胞组合在一起,让抗体识别肿瘤上特异性的受体或抗原,将T细胞和肿瘤细胞拉在一起,然后把肿瘤细胞“干掉”。
当然,CAR-T如今面临着各种各样的挑战,如CAR-T现在只是对血液瘤效果较好,而对实体瘤效果较差,主要原因可能是进不去实体瘤,也可能是生物学效果不行。另外一个挑战是,CAR-T是一个活体药物,它的化学成分生产和控制(CMC)完全不一样。从一开始病人要做抽血、存储、回输,一套流程下来成本很高,所以它在商业化上的挑战也很大。
但是针对各样挑战,各个生物技术公司都在做一些新的研究以求突破。可能在不远的将来,在某一点上会有一些重大突破,而任何一个点上的突破都很有可能会带来一些革命性的药物。
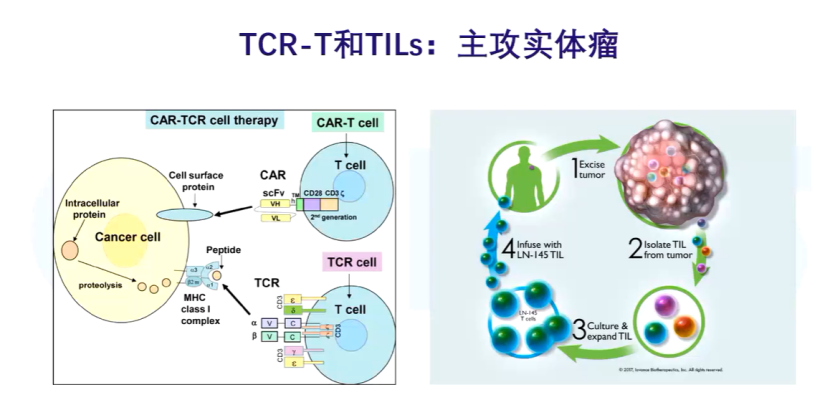
针对实体瘤,各种各样细胞疗法都在被尝试,除了CAR-T,还有TCR-T。针对CAR-T进不了实体瘤的问题,可以把已经进到肿瘤内的TILs分出来,这样它就能发挥归巢的功能。
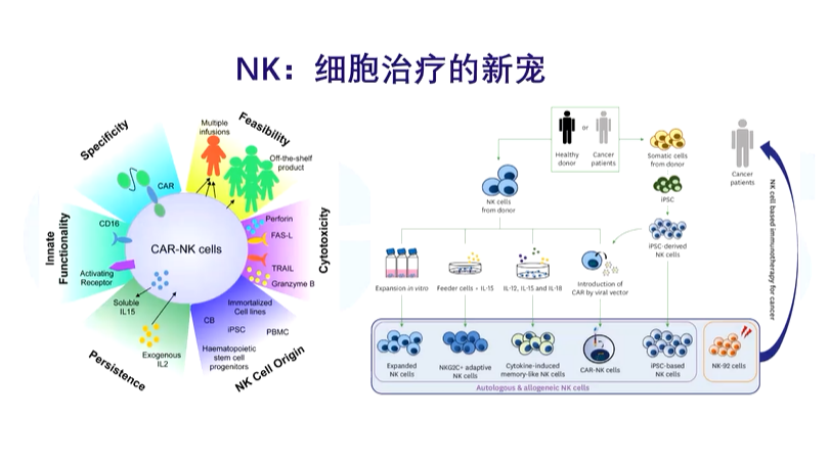
同时,从去年开始NK细胞也受到关注,因为NK细胞更像药,它具有更温和、通用等特点,副作用小,半衰期更短。另一方面,它的杀伤力相对较弱,所以有时需要像传统药物一样需要多次给药。
NK最大的好处之一是它不同于CAR-T,不用做成异体的(一个病人只能对应一种特异性CAR-T,目前还没有效果较好的通用型CAR-T),NK细胞可以通过诱导多能干细胞生成,这样就可以进行批生产,更加像传统药物,还可以有望降低成本。
也有人会提出疑问:NK细胞半衰期短,需要多次给药,成本不是又变高了吗?这个问题的答案其实比较复杂,但在NK领域里,美国Fate公司最近公布了一些临床数据,虽然没有那么惊艳,但是从数据上看还是不错的,现在NK也已经成为了一个比较重要的细胞治疗方向。
除细胞外,溶瘤病毒也是一个技术组合平台。溶瘤病毒以前上过市,但效果很差。如今通过对其进行技术组合,一方面溶瘤病毒可以选择性地杀死肿瘤细胞,另外一方面,把它看成一个递送的平台,去表达PD-1,表达各种细胞因子。
药物发现的赋能技术——人工智能
人工智能作为许多领域的赋能技术,让我们不禁想到,人工智能技术能否为生物制药领域带来了一些改变呢?
近年来,人工智能作为一个特别热门的领域,与它相关的融资和公司也非常多。但是,它在生物医药行业内也不缺争议:“人工智能真的有那么神奇吗?”、“人工智能是否真的能为制药带来实质性的改变?”
关于人工智能的争议可谓是仁者见仁,智者见智,不论怎样,人工智能作为赋能工具,在其他领域的成功应用是大家有目共睹的,在生物医药领域可能也不例外。但是,由于生物医药领域的特点,人工智能在该领域的应用不一定能像在其他行业一样简单,但也不会像很多人说的那么悲观,更需要以一种比较开放的心态看待。
但不得不承认,人工智能领域的进展十分迅速。在比如化学合成领域,英国利物浦大学发在《自然》上了一个封面文章,设计了一个化学机器人在8天内完成了668次实验。
人工的速度要慢很多,一位有经验的化学家,一周大约只能做十几个化学反应实验。可以预见,化学合成方面的自动化、智能化会比制药领域更早到来,并且很快就会商业化。
目前,半自动的实验室的自动化、人工智能的合成设计,都已经商业化了。如果技术继续进展,全自动化学机器人的商业化产品极有可能会在短短五年之内出现,这将大大加速化学合成的效率,并赋能小分子药物的发现。
除此之外,我们关注较多的还有人工智能在生物学领域的进展,如Google旗下的DeepMind公司开发了预测蛋白质三维结构的软件,可见人工智能已经真正深入到了分子层面。
众所周知,用传统的方法解析一个蛋白的结构是不容易的,如做得很好的结构生物学家,每年可能也只能做出几个蛋白质结构,但人工智能可以很快地根据基因序列对蛋白质的三维结构进行预测,它对生物学发展的推动将是不言而喻的。
DeepMind最新的成果是,他们把地球上几乎所有蛋白的结构都预测了一遍,并做成了一个数据库。虽说其精度肯定不够,但是对于简单蛋白的预测,他们的精度完全可以和实验室的冷冻电镜相媲美。
当然,生物学的构象是动态的,存在着各种各样的蛋白质相互作用,以及与小分子相互作用,这是一个非常复杂的过程,所以这些简单的蛋白质结构预测,目前还没有对制药领域产生革命性的影响。
但重要的是,它带来了一个值得关注的预期,就像火车刚发明出来时跑得比马车慢,但它后面跑得越来越快,我们不能因为火车起初跑得慢就轻率地断定它不行,人工智能技术也一样。
人工智能对于制药的影响可能不是暴风骤雨式的,而是在各个点上会有润物细无声的改变,最终达到由量变到质变,比如在制药研究过程中,它可以辅助药物设计、查找文献、推动化学合成的效率、寻找靶点等。
直到某一天,将所有的这些点串联起来以后,可能就会发生一个革命性的变化。但这一天什么时候会到来?没有人知道。可能一夜之间就来了,也有可能100年后才来,这种颠覆性的技术是很难预测的。
药物递送技术的革新
对于刚才介绍的这么多新技术,从实操层面来说,最关键的一个就是药物递送。
早在2003年,RNA药物最受关注的时候,就忽略了它的递送问题。RNA很难递送至人体,很多病毒的遗传物质是RNA,人体是不可能主动让这类病毒进入的,大自然设计了多层的防火墙。因此RNA药物怎样进入人体,这对所有核酸新技术都是最关键的问题。
因此,像张锋、刘如谦这些做基因编辑的科学家,都在开发自己的递送技术,可见递送技术非常重要,而且十分缺乏。
递送系统方面,有一个脂质纳米颗粒(LNP)的技术,现在有各种各样的研究去尝试提高它的递送效率,或者做靶器官的选择性,众多科研人员都在不断琢磨它。
我认为肝靶向技术是目前最成熟、最好的一项技术,但它也有一个缺陷:肝细胞上的受体把核酸带到细胞里后,它就会进入内吞体。但是核酸的极性很强,无法从内吞体中出来,所以一般效率非常低,就是说一万个分子里面只能逃出几个分子。
因此,如果有人能够把这个机制研究清楚,效率提高一些,哪怕变成10%,那么这个领域也会发生革命性变化,因为一旦有了这个技术,用药的剂量会下降很多,相应的辅料会少很多,这种成果甚至可能获诺贝尔奖。
当然,也有公司尝试过,像ArrowHead公司就曾经用一个蜜蜂的毒素给内吞体打孔,让小核酸出来,但是在内吞体上面打孔会导致药物毒性增大。所以到目前依然没有研究出小核酸分子准确的逃出机制,也有在纳斯拉克上市的小公司,号称他们找到了一些规律,但是至今没有看到可靠的数据。
另外一个思路就是模拟自然,比如外泌体递送,外泌体是我们细胞分泌的、包裹许多RNA和蛋白的小泡,是否能将它归巢的功能利用起来。此外,红细胞没有细胞核,是否可以把它作为一个药物载体,此外,血小板等也可以做这类尝试。许多欧美的公司都在研究这些非常新奇的递送技术。
乔治·丘奇(George Church)创立的Dyno的公司,正在尝试用人工智能进行AAV的蛋白设计,去创造一个人类从未想到过的AAV蛋白。同样,哈佛大学的另一位教授创立的公司也在进行这方面的研究,还有一项FlagShip孵化的Ring Therapeutics公司,正在致力于新病毒递送的研究。
注:本文主要是基于谢雨礼博士分享的内容整理而成,此篇为完整版,上一篇只是分享内容的上半部分。
谢雨礼博士介绍

微境生物医药科技(上海)有限公司的CEO及创始人。毕业于南开大学化学系,中国科学院上海药物研究所博士,哥伦比亚大学博士后。曾在美国哥伦比亚大学医学院,扬子江药业,日本大冢制药和药明康德等研究机构和制药公司任职,2017年和2018年先后创建了生物医药公司苏州偶领和上海微境并担任CEO。
谢雨礼博士拥有超过20年药物研发和项目管理经验,熟悉新靶点和前沿技术,以及法规,政策和市场等。业余时间积极参加和组织行业活动,担任中国科学院上海药物研究所苏州药物创新研究院副院长、沈阳药科大学亦弘商学院课程教授和《药学进展》编委等职务,其发表的科普文章和综述受到生物医药行业的好评。
仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
文中图片、视频为授权正版作品,或来自微信公共图片库,或取自公司官网/网络
任何问题,请与我们联系(电话:13651980212。微信:27674131。邮箱:contact@drugtimes.cn)。衷心感谢!
 点击这里,报名参加第三届中国新药CMC高峰论坛!
点击这里,报名参加第三届中国新药CMC高峰论坛!

















 点击这里,报名参加第三届中国新药CMC高峰论坛!
点击这里,报名参加第三届中国新药CMC高峰论坛!


 个人中心
个人中心
 我是园区
我是园区




