
责编 | 兮
减数分裂是有性生殖特有的细胞生物学事件,也是配子发生能否正常进行的关键。为了完成减数分裂,生殖细胞需要经过一轮DNA复制,两轮连续的细胞分裂,最终形成染色体数目减半的单倍体配子。在哺乳动物的精子发生过程中,精原细胞先是经历多轮有丝分裂使精原细胞群体得到扩增,之后停止有丝分裂,启动减数分裂进程,所以该过程也称为有丝分裂-减数分裂转换 (mitosis-to-meiosis transition) 或者减数分裂启动 (meiotic initiation)。生殖细胞减数分裂启动是一个受到精准调控的发育过程,需要激活大量减数分裂基因表达,同时伴随染色质结构的动态调整。因此,表观遗传机制是如何调控减数分裂启动这一特殊的细胞命运转变过程,是发育生物学领域重要的科学问题。
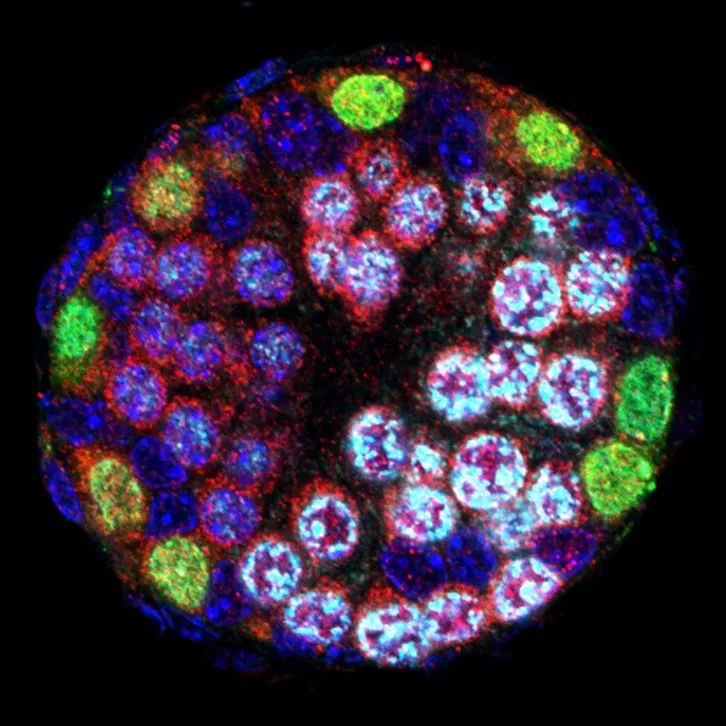
封面图片:展示了小鼠生精小管中减数分裂启动的发育过程,白色标记的细胞代表刚好完成DNA复制并进入减数第一次分裂前期(Meiotic prophase I)的精母细胞。
针对此关键问题,2022年4月11日,复旦大学生命科学学院、遗传工程国家重点实验室、粤港澳大湾区精准医学研究院 (广州) 林鑫华团队在Developmental Cell以封面文章的形式发表研究论文 Znhit1 controls meiotic initiation in male germ cells by coordinating with Stra8 to activate meiotic gene expression 。该研究揭示了染色质重塑因子Znhit1在减数分裂启动中的重要作用,并阐释了Zniht1与组织特异性转录因子协同调控基因表达的新模式。值得注意的是,该团队前期一系列研究相继发现了染色质重塑过程在干细胞命运决定和组织稳态维持中的重要功能和作用机制【1-3】。

研究者发现,染色质重塑因子Znhit1在小鼠睾丸高表达,并且在精子发生早期存在动态表达特征。为了阐明染色质重塑是否参与调控减数分裂启动,研究者首先构建了在精子发生胚胎期阶段的Znhit1条件性敲除小鼠模型。研究者发现,Znhit1缺失导致小鼠精子发生过程中精母细胞无法形成,最终导致无精症。同时,Znhit1对于精原干细胞的维持和分化不是必需的。令人意外的是,在不影响减数分裂启动核心转录因子Stra8表达的情况下,Znhit1缺失导致生殖细胞无法启动减数分裂。研究者发现,Znhit1缺失导致多个减数分裂启动的重要事件,包括DNA复制、DNA双链断裂及联会复合体形成等,都无法正常发生。进一步研究表明,Znhit1通过介导组蛋白变体H2A.Z整合,协同减数分裂启动核心转录因子Stra8,共同调控包括Meiosin在内的减数分裂基因表达。研究者利用KAS-seq技术【4】表明,Znhit1缺失会破坏减数分裂基因转录泡(transcription bubble)的形成,为理解H2A.Z调控基因表达的分子机理提供了新的思路。
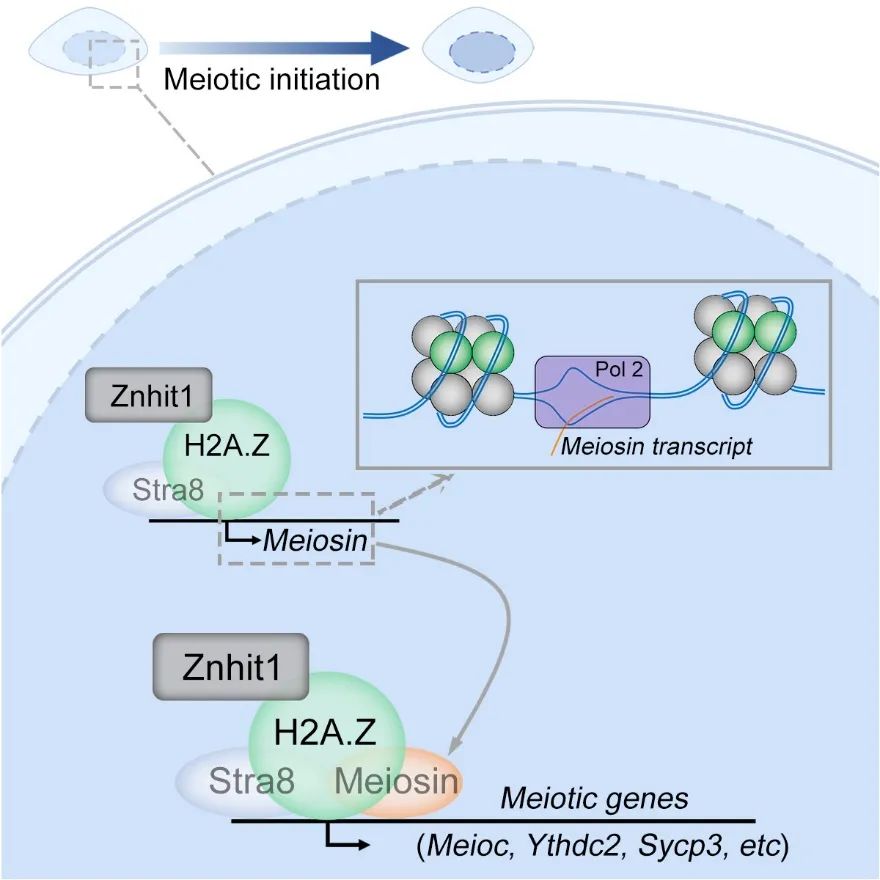
Znhit1介导的染色质重塑调控减数分裂启动的模式图
综上所述,该研究使用条件敲除小鼠模型,结合发育生物学和表观遗传组学等研究手段,证明染色质重塑因子Znhit1是减数分裂启动的关键表观遗传调控因子(上图)。此项研究提出了染色质重塑与组织特异性转录因子协同调控减数分裂启动的新模型,为研究特定染色质结构决定细胞命运转变的分子机理提供了新的见解。
复旦大学生命科学学院孙申飞博士、姜雅梅博士、章巧利博士为论文共同第一作者。复旦大学林鑫华教授、上海市生物医药技术研究院李润生研究员、复旦大学姜宁副教授、赵冰研究员为论文共同通讯作者。
附:林鑫华教授目前担任复旦大学粤港澳大湾区精准医学研究院(广州)执行院长,正在组建研究团队,聚焦类器官和肺生物学的研究。研究团队同时依托复旦大学生命科学学院、遗传工程国家重点实验室、复旦大学类器官中心等多个研究平台,针对重大人类疾病,开展生物学和转化医学研究。研究团队长期招聘博士后、科研助理与实习生。研究院科研条件优越,待遇优厚,欢迎有兴趣的同学投递简历。

原文链接:
https://doi.org/10.1016/j.devcel.2022.03.006
参考文献
1. Zhao B, Chen Y, Jiang N, Yang L, Sun S, Zhang Y, Wen Z, Ray L, Liu H, Hou G, Lin X. Znhit1 controls intestinal stem cell maintenance by regulating H2A.Z incorporation. Nat Commun. 2019;10:1071.
2. Sun S, Jiang N, Jiang Y, He Q, He H, Wang X, Yang L, Li R, Liu F, Lin X, Zhao B. Chromatin remodeler Znhit1 preserves hematopoietic stem cell quiescence by determining the accessibility of distal enhancers. Leukemia. 2020;34:3348-3358.
3. Xu M, Yao J, Shi Y, Yi H, Zhao W, Lin X, Yang Z. The SRCAP chromatin remodeling complex promotes oxidative metabolism during prenatal heart development. Development. 2021;148.
4. Wu T, Lyu R, You Q, He C. Kethoxal-assisted single-stranded DNA sequencing captures global transcription dynamics and enhancer activity in situ. Nat Methods. 2020;17:515-523.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




