Sci Adv | 谢辉团队发布埃米银抗菌抗炎促进皮肤修复再生最新研究成果
收藏
关键词:
新研究
资讯来源:BioArt + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2020-11-06
糖尿病皮肤慢性难愈创面和大面积烧/烫伤的治疗一直是临床上亟待攻克的难题
[1-2]
。损伤的皮肤为细菌定植和繁殖提供了良好的环境,细菌滋生引起的过度炎症反应是导致皮肤创面迁延不愈的重要原因
[3-4]
。金属银具有良好的抗菌消炎作用,各类银制剂用于创面抗感染和伤口修复已有两千多年历史
[5]
。
约一百年前,抗生素的发现及后续的量产应用减少了银的应用,然而,由于抗生素的广泛和大量使用,细菌耐药问题愈发严重
[5-6]
。随着纳米技术飞速发展,银在医药界再次受到广泛关注
[5-8]
。研究表明,尺寸越小的粒子具有更强的细胞穿透能力和杀伤性
[9-10]
。
2019年,中南大学埃米医学研究中心主任、湘雅医院–埃米迦联合研究中心主任谢辉教授课题组在国际上首次公布了其采用自主研发的自动化蒸汽–冷凝设备制备的埃米尺寸
(1埃米=0.1纳米)
单质银的广谱抗癌性质。近日,谢辉教授团队以原创论著形式在Science Advances发布了题为
“Ångstrom-scale silver particle–embedded carbomer gel promotes wound healing by inhibiting bacterial colonization and inflammation”
的最新研究成果,
首次报道负载埃米银的卡波姆凝胶
(简称埃米银凝胶)
可通过强效杀菌和减轻炎症促进皮肤修复再生。
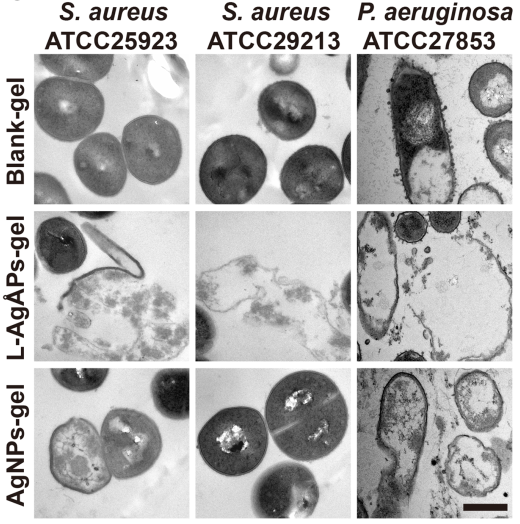
在本研究中,团队人员证实埃米银凝胶可在体外强效杀灭多种细菌,包括铜绿假单胞菌、耐甲氧西林和甲氧西林敏感金黄色葡萄球菌,其杀菌效应显著强于纳米银凝胶
(图1;仅展示电镜下形态变化结果)
。
注:埃米银凝胶:L-AgÅPs-gel;纳米银凝胶:AgNPs-gel
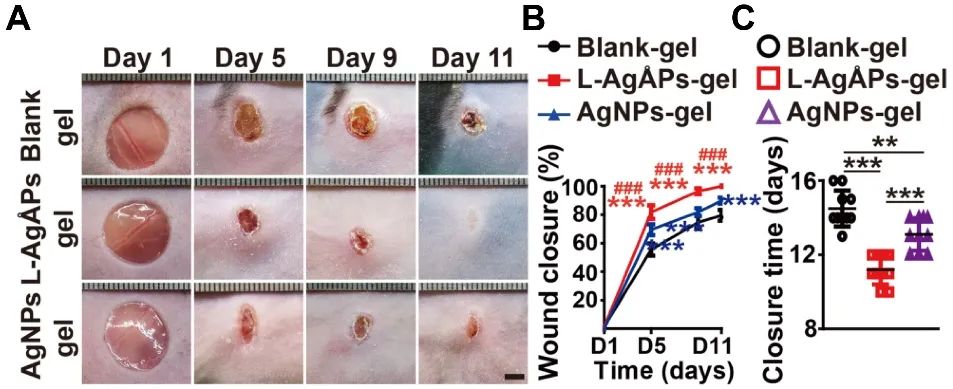
体内实验结果显示,局部涂抹埃米银凝胶可显著抑制糖尿病小鼠皮肤缺损部位和普通小鼠大面积烫伤区域细菌定植,减轻伤口炎症反应,从而加速创面愈合
(图2;仅展示埃米银凝胶抑制糖尿病小鼠皮肤伤口细菌定植、减轻炎症反应和促进伤口愈合的部分图片)
。纳米银凝胶也具有一定抗菌、抗炎和促进皮肤修复的作用,但其效果均明显弱于埃米银凝胶
(图2)
。
图2 埃米银凝胶促进糖尿病小鼠皮肤伤口愈合
注:
(A)伤口大体观图片;
(B-C)伤口闭合率和愈合时间统计
治疗剂量的埃米银凝胶对机体正常皮肤修复相关细胞的体外活性、小鼠多项生理功能和脏器组织结构无明显影响,涂抹埃米银凝胶数天后并未引起小鼠其它脏器银蓄积。
据悉,
谢辉
教授为论文通讯作者,
陈春媛
博士生为论文的第一作者,
殷豪
博士生、
陈霞
博士等为论文的重要参与作者,湘雅医院为第一作者兼通讯作者单位。
谢辉
教授团队正在继续深入研究埃米银在抗肿瘤、抗菌、抗炎和抗病毒方面的功效与机制,评估其对机体正常组织脏器的长期影响。
https://advances.sciencemag.org/content/advances/6/43/eaba0942.full.pdf
[1]
S. O. Blac
k
low, J. Li, B. R. Freedman, M. Zeidi, C. Chen, D. J. Mooney, Bioinspired mechanically
active adhesive dressings to accelerate wound closure.
Sci. Adv.
5, eaaw3963 (2019).
[2] S. A. Eming, P. Martin, M. Tomic-Canic, Wound repair and regeneration: mechanisms, signaling, and translation.
Sci. Transl. Med
. 6, 265sr266 (2014).
[3] L. R. Kalan, M. B. Brennan, The role of the microbiome in nonhealing diabetic wounds.
Ann. N Y Acad. Sci
. 1435, 79-92 (2019).
[4] M. Arifuzzaman, Y. R. Mobley, H. W. Choi, P. Bist, C. A. Salinas, Z. D. Brown, S. L. Chen, H. F. Staats, S. N. Abraham, MRGPR-mediated activation of local mast cells clears cutaneous bacterial infection and protects against reinfection.
Sci. Adv.
5, eaav0216 (2019).
[5] L. Xu, Y.-Y. Wang, J. Huang, C.-Y. Chen, Z.-X. Wang, H. Xie, Silver nanoparticles: Synthesis, medical applications and biosafety.
Theranostics
10, 8996-9031 (2020).
[6] A. Gupta, S. Mumtaz, C. H. Li, I. Hussain, V. M. Rotello, Combatting antibiotic-resistant bacteria using nanomaterials.
Chem. Soc. Rev.
48, 415-427 (2019).
[7] J. S. Möhler, W. Sim, M. A. T. Blaskovich, M. A. Cooper, Z. M. Ziora, Silver bullets: A new lustre on an old antimicrobial agent.
Biotechnol. Adv.
36, 1391-1411 (2018).
[8] A. C. Burdusel, O. Gherasim, A. M. Grumezescu, L. Mogoanta, A. Ficai, E. Andronescu, Biomedical Applications of Silver Nanoparticles: An Up-to-Date Overview.
Nanomaterials
8, 681 (2018).
[9] J. Kang, M. J. Dietz, K. Hughes, M. Xing, B. Li, Silver nanoparticles present high intracellular and extracellular killing against Staphylococcus aureus.
J. Antimicrob. Chemother.
74, 1578-1585 (2019).
[10] G. Franci, A. Falanga, S. Galdiero, L. Palomba, M. Rai, G. Morelli, M. Galdiero, Silver nanoparticles as potential antibacterial agents.
Molecules
20, 8856-8874 (2015).


 药选址
药选址


