▎药明康德内容团队报道
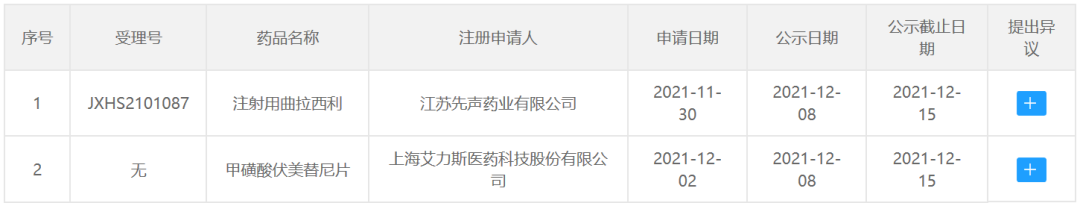
12月8日,中国国家药品监督管理局药品审评中心(CDE)最新公示,两款新药拟纳入优先审评,分别是
艾力斯医药第三代EGFR-TKI甲磺酸伏美替尼片,及先声药业以高达1.7亿美元引进的短效CDK 4/6抑制剂注射用曲拉西利(trilaciclib)。
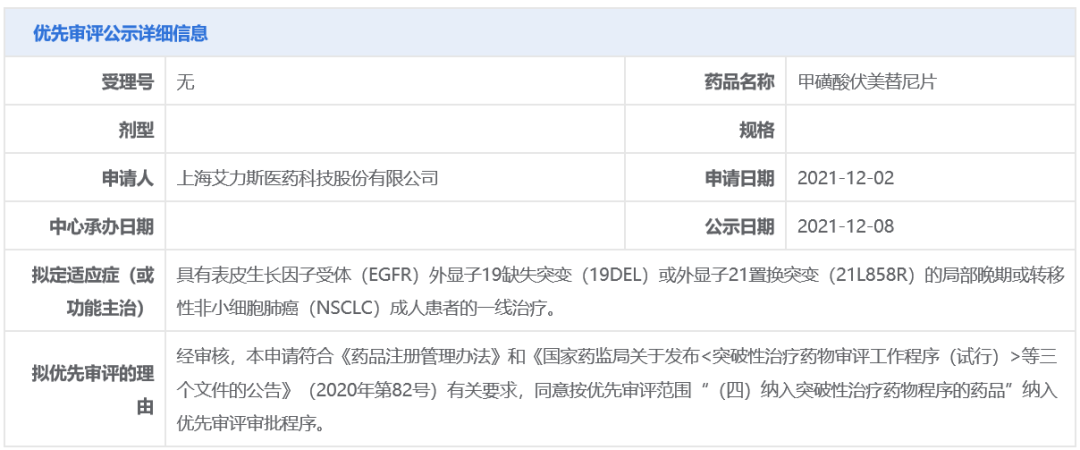
甲磺酸伏美替尼(商品名:艾弗沙)是艾力斯医药自主研发的1类创新药,已于2021年3月在中国获批上市,用于治疗既往经EGFR-TKI治疗时或治疗后出现疾病进展、并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性NSCLC成人患者。不久前,伏美替尼一线治疗晚期NSCLC的适应症刚在中国被纳入突破性治疗品种。
此次甲磺酸伏美替尼片以“纳入突破性治疗药物程序的药品”拟纳入优先审评,针对适应症为:具有表皮生长因子受体(EGFR)外显子19缺失突变(19DEL)或外显子21置换突变(21L858R)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
此前,伏美替尼已在3期临床研究FURLONG中,达到无进展生存期(PFS)的主要研究终点。
相比接受一代EGFR-TKI治疗的对照组,伏美替尼一线治疗具有EGFR外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性NSCLC成人患者,显示了具有显著统计学意义和临床意义的PFS获益。
艾力斯医
药曾在
新闻
稿中表示,
伏美
替尼
一
线治疗晚期
NSC
LC的适应症
预计在今年申报NDA,有望于2022年获批
。
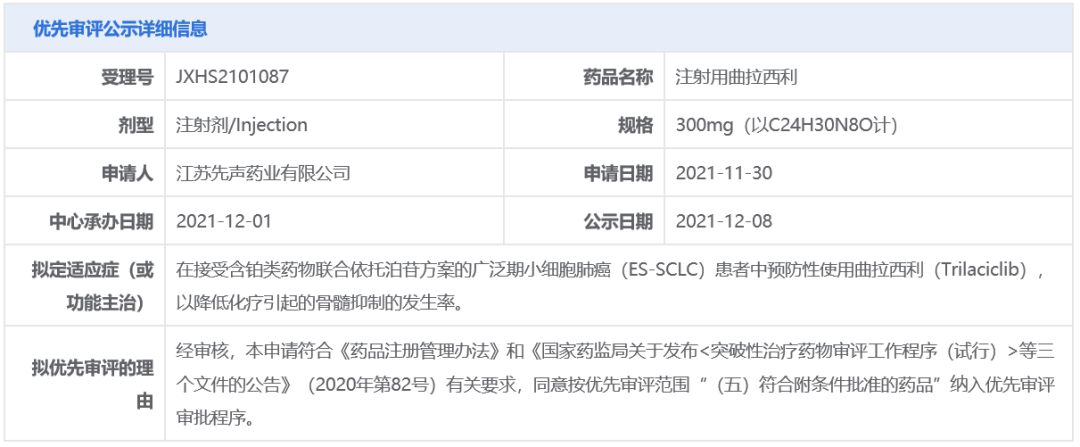
先声药业:注射用曲拉西利
曲拉西利是一款短效CDK 4/6抑制剂,它通过短暂的G1期阻滞,降低了骨髓造血干细胞的复制负担,从而缓解了骨髓造血干细胞的耗竭。它已于2021年2月获得FDA批准上市,用于降低广泛期小细胞肺癌患者在接受某些类型化疗时出现的骨髓抑制频率。2020年8月,先声药业与G1 Therapeutics达成高达1.7亿美元的独家许可协议,获得这款创新疗法在大中华地区所有适应症的开发和商业化权益。
此次曲拉西利以“符合附条件批准的药品”拟纳入优先审评,针对适应症为:在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌(ES-SCLC)患者中预防性使用曲拉西利,以降低化疗引起的骨髓抑制的发生率。
曲拉西利的有效性已得到3项在广泛期小细胞肺癌患者中进行的随机、双盲、含安慰剂对照研究的支持。综合起来,这些研究随机分配了245例患者在化疗前接受静脉输注曲拉西利或安慰剂。在所有3项研究中,与接受安慰剂的患者相比,接受曲拉西利的患者发生重度中性粒细胞减少的几率较低。在那些出现严重中性粒细胞减少的患者中,平均而言,接受曲拉西利治疗的患者症状持续时间更短。
希望艾力斯医药甲磺酸伏美替尼新适应症,及先声药业曲拉西利早日在中国获批,为更多患者带来新的治疗选择。
参考资料:
[1]中国国家药监局药品审评中心. Retrieved Dec. 8,2021, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2]突破 | 艾弗沙®一线治疗晚期NSCLC注册研究取得阳性结果. Retrieved Nov 1,2021, from https://www.allist.com.cn/newsd/101/19.html
[3]先声药业和G1 Therapeutics宣布签署有关Trilaciclib产品在大中华地区的独家许可协议. Retrieved Aug 03,2020, from http://www.simcere.com/news/detail.aspx?mtt=98
[4]先声药业宣布全球首个全面骨髓保护药物曲拉西利上市许可申请获受理. Retrieved Nov 30,2021, from https://mp.weixin.qq.com/s/uPxPiwEsgm5tDIUPzzP6Cg
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。








 个人中心
个人中心
 我是园区
我是园区




