
DNA甲基化作为重要的表观修饰,在调控基因的时空特异性表达中起重要作用,参与X染色体失活、基因组印记和重复序列抑制等生命过程。
人体DNA甲基化在有丝分裂过程中保持稳定,这对细胞保持谱系特性有重要意义。
近日,来自美国密歇根大学的研究团队发现:随着细胞分裂次数的累积将导致特定区域甲基化的选择性丢失,其结果是产生非正常蛋白质,干扰正常细胞的构成,使细胞的功能和身份识别遭到大规模破坏,细胞变异并可能导致癌症。
所以,研究团队提出甲基化缺失是导致癌症的一个重要成因。
研究发表在《Nature Communications》上,原文题目为“Cell division drives DNA methylation loss in late-replicating domains in primary human cells。”

首先,研究团队使用原代人类细胞培养物来密切跟踪细胞群的体外复制,跟踪每次传代的累积细胞分裂(种群倍增,PD),在每次传代时,保留一部分细胞用于使用Infinium MethylationEPIC阵列(Illumina)进行DNA甲基化分析。
DNA甲基化主要发生在CpG二核苷酸对的C(胞嘧啶)上,研究团队测定单个DNA分子内新旧CpG的甲基化状态、甲基化的维持速率以及维持中可能伴随发生的从头甲基化事件。
研究发现,DNA甲基化可以在复制叉经过后数分钟内迅速恢复到较高的水平,说明存在一个复制偶联的快速维持阶段;即使复制叉经过后数小时,甲基化维持仍在进行,说明同时存在一个复制非偶联的缓慢维持阶段。
然后,研究团队分析细胞有丝分裂中DNA甲基化维持的动态过程和相关调控机制。
结果发现DNMT-PCNA以及UHRF1-LIG1的相互作用促进复制偶联阶段甲基化的快速维持,UHRF1-H3K9me2/3的相互作用促进复制非偶联阶段的甲基化维持速率,核小体的存在本质上会减缓复制非偶联阶段的甲基化维持速率。
下一步,研究团队想看看随着细胞分裂(种群倍增,PD)的增加会不会发生DNA甲基化丢失。
实验发现随着累积细胞分裂(种群倍增,PD)的不断增加,发现部分甲基化结构域 (PMD) 内的DNA甲基化开始缺失。
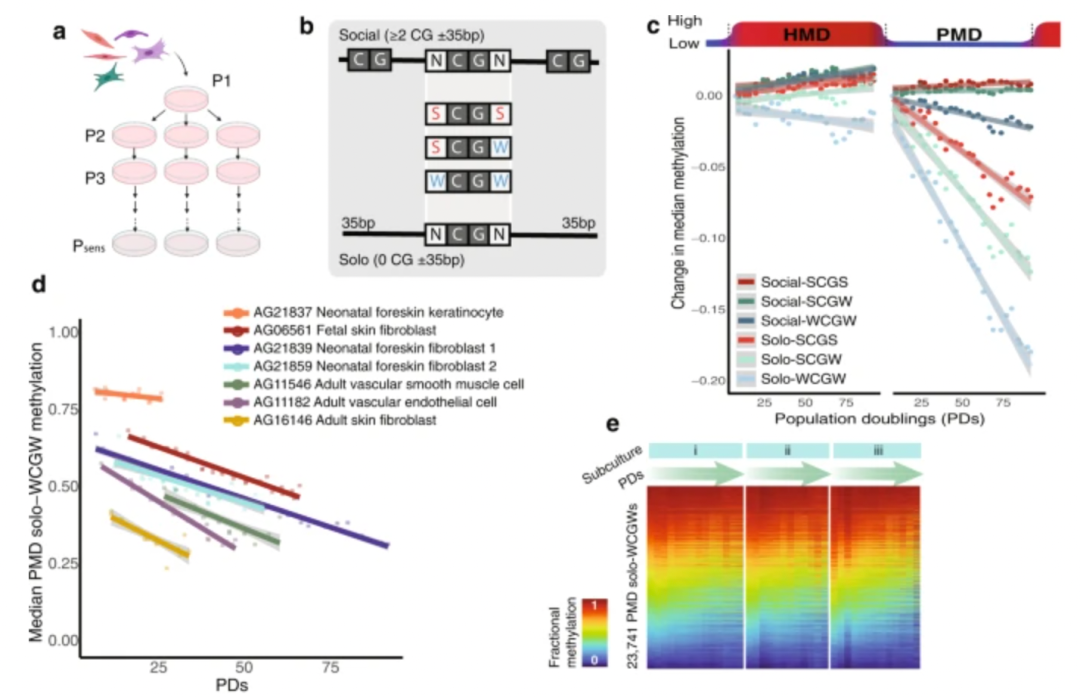
图1:部分甲基化结构域 (PMD) 内的DNA甲基化缺失由细胞分裂驱动
研究团队随后用丝裂霉素 C (MMC) 瞬时处理几个原代细胞 ( n = 3) 3 小时,MMC是一种可以实现完全永久细胞周期停滞的DNA复制抑制剂,可以让细胞维持稳态数周,不发生有丝分裂。
结果发现原代细胞中的两个在通过MMC进行DNA合成停滞时没有发生显著的低密度CpG处 DNA甲基化的丢失(PMD单-WCGW低甲基化)。
这些提供了累积细胞分裂(种群倍增,PD)与PMD单-WCGW低甲基化之间直接因果关系的证据。
再下一步,研究团队使用携带端粒酶逆转录酶 (TERT) 的慢病毒构建体使原代成纤维细胞 (AG06561) 永生化,在选择永生化和对照载体细胞后,在多个传代中分析DNA甲基化。
永生化细胞比对照细胞实现了显着更高的细胞分裂(种群倍增,PD),研究团队在超过150次PD后终止了实验。
在第150次传代中,永生化细胞保持高度增殖。D相比之下,对照细胞只达到了40个PD,这时,大多数细胞CpG已降至低水平的甲基化。
接下来,研究团队发现甲基化缺失也是导致癌症的一个重要成因。
DNA甲基化作为基因启动“开关”(启动子),当基因体内的启动子出现甲基基团损失,基因就会出错。其结果是产生非正常蛋白质,干扰正常细胞的构成,使细胞的功能和身份识别遭到大规模破坏,细胞变异并可能导致癌症。
所以,结果表明衰老和肿瘤中甲基化丢失的CpG位点表现出较低的甲基化维持速率和从头甲基化频率,可能造成一些不易维持的CpG位点在不断的有丝分裂中逐渐丢失甲基化,这是衰老和肿瘤中甲基化丢失的重要的机制。
研究团队表示这将为治疗癌症提供新途径。如果我们找到一种方法,能使甲基基团转移到暴露的癌细胞DNA序列上,就有可能阻止癌细胞繁殖。
最后,研究团队提出了一个模型“RepliTali”来估计细胞分裂(种群倍增,PD)与DNA甲基化丢失间的关系。
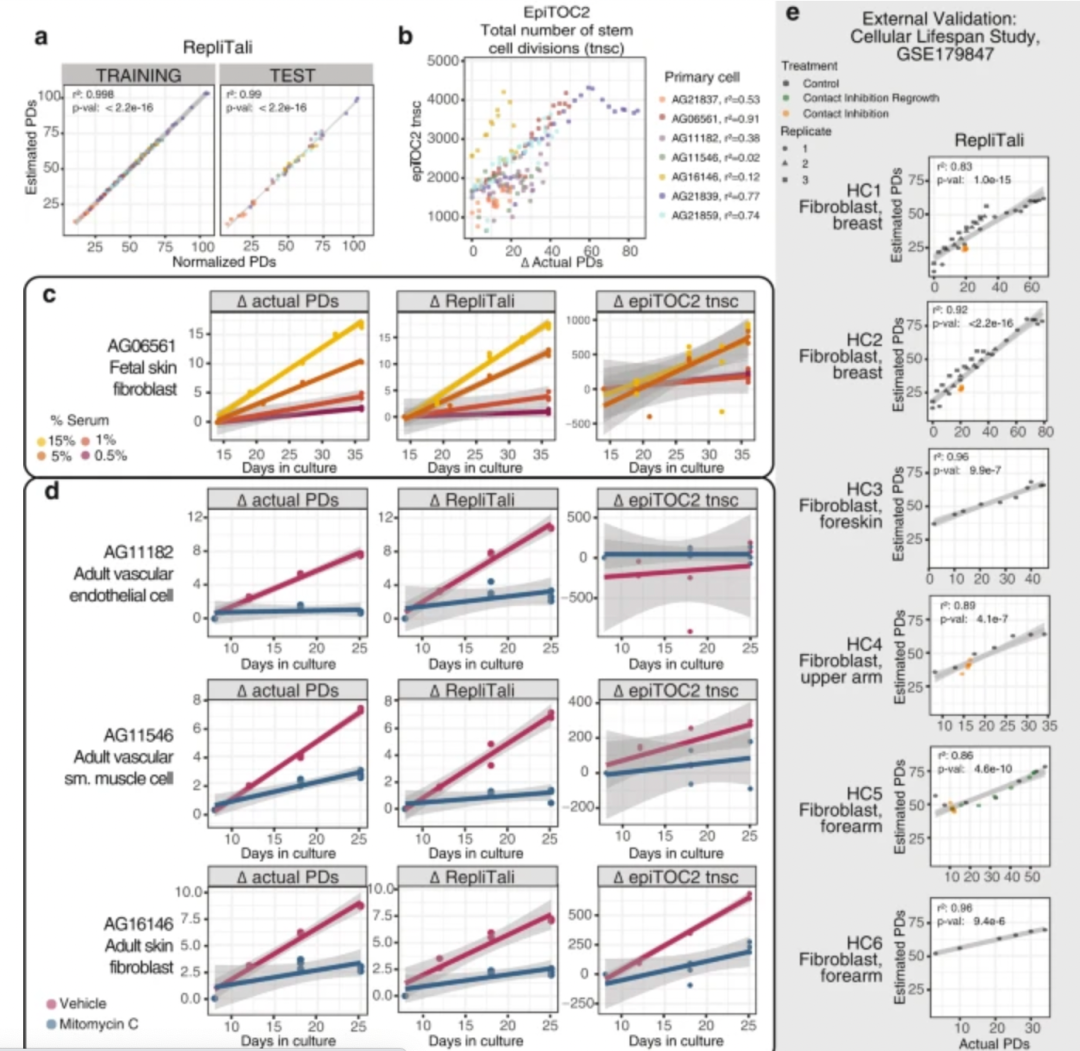
图2:RepliTali 的构建和性能
部分甲基化结构域 (PMD) 内的DNA甲基化缺失,在正常组织中随着年龄的增长而进展,并且在癌症中进一步恶化。
研究发现通过这种模型也再次证实了DNA低甲基化是由增殖相关的DNA复制直接驱动的。
目前已有500+行业精英加入基因俱乐部
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区





