
近年来,随着中国创新药行业的迅速发展壮大,我国的药品审评审批政策也进行了密集地改革,政策支持下大量资本涌入医药行业,中国新药开发正在进入全新的时代。面对如此快节奏的市场变化,如何跟踪行业前沿技术进展,洞悉市场态势,是所有生物医药企业都需要思考的问题。
为此,医药魔方依托自身的药品全产业链数据资源,梳理了近十年的药品审评审批数据,从药品IND申报、临床试验开展、NDA申报再到最后的上市药品分析四大模块都进行了深入分析,最终推出了今年最新的《2022年中国新药注册审评报告》,并将于2023年2月22日晚18:30进行直播解读,旨在帮助企业和投资者们更好地了解产业趋势,把握竞争优势。

报告亮点
IND药品分析
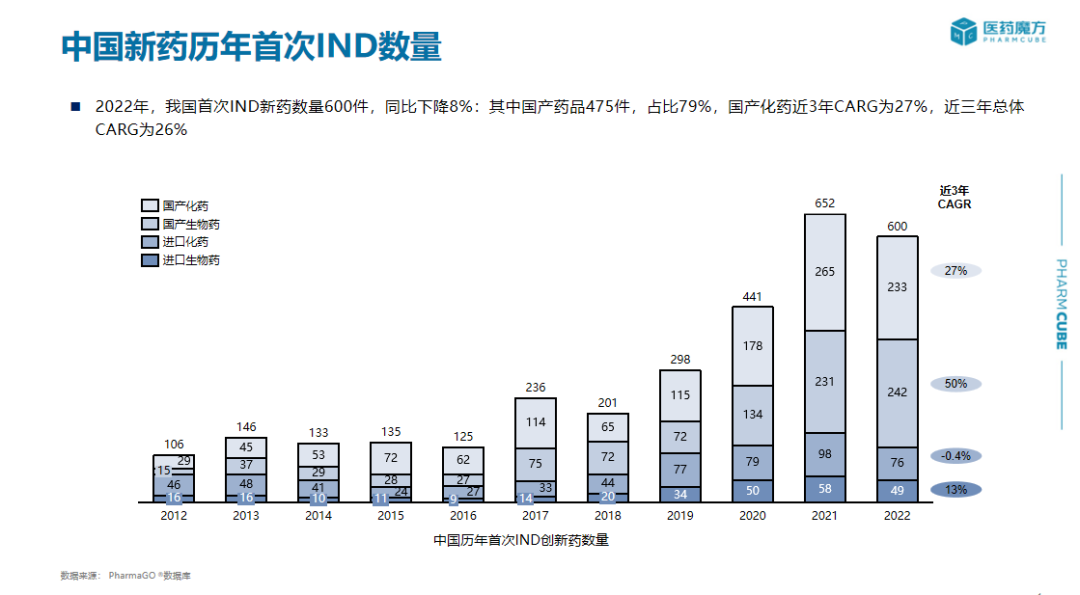
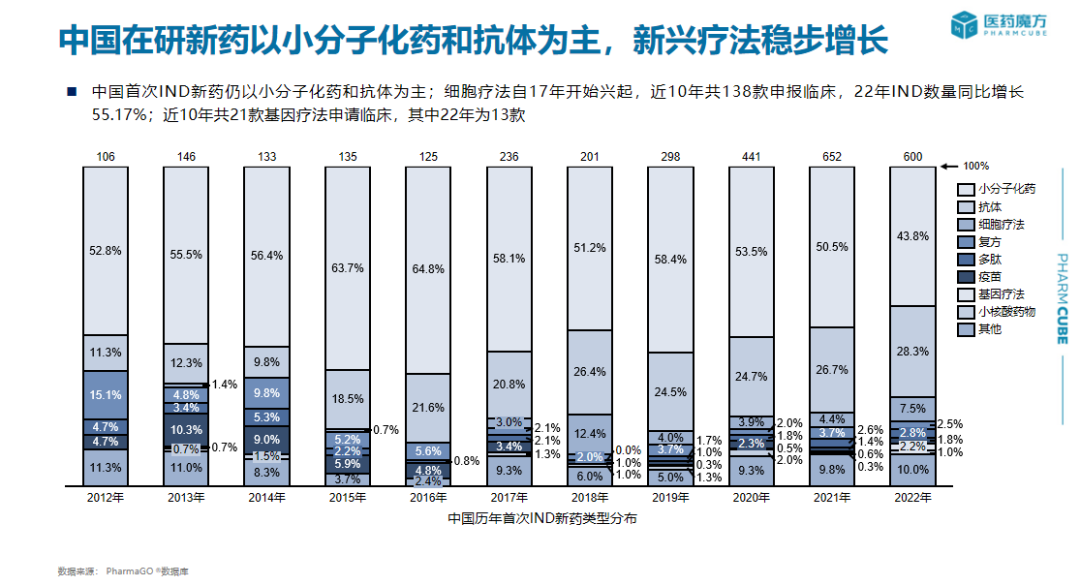
创新药申报临床趋势、在研新药项目组成、中国在研产品靶点分析、新药研发趋势
临床试验分析
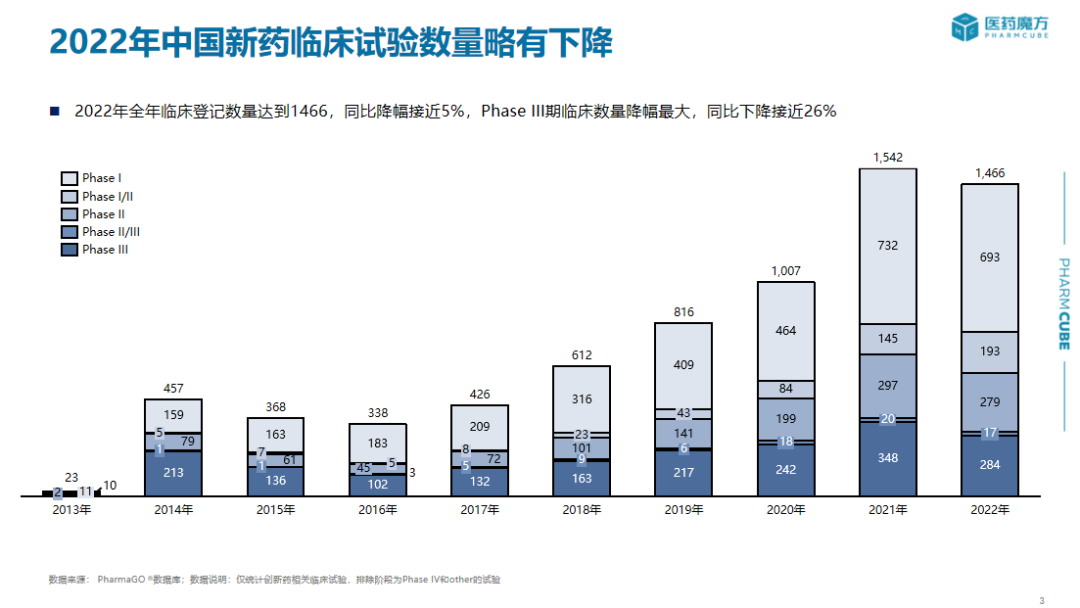
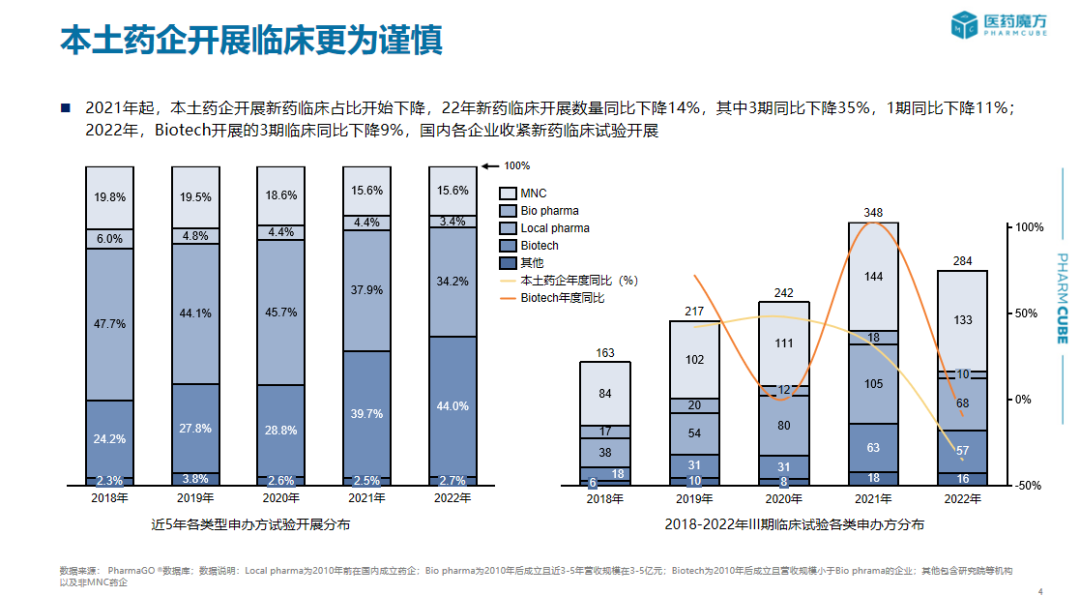
历年新药临床试验登记情况分析、不同临床阶段登记适应症分布情况、临床试验各类申办方分布情况、国内外核心临床开展趋势
NDA药品分析
2022NDA产品类别分布及代表产品、历年NDA产品当前状态统计、License-in产品NDA状况分析
上市药品分析
中国历年首次获批新药情况、历年上市药品审批时长分析、近十年中国上市产品疾病领域分布、2022年全球/国内首创新药统计
报告一览
数据来源
2022年中国新药注册审评报告数据来源基于医药魔方PharmaGo基础数据库&医药魔方NextPharma全球新药数据库,同时覆盖了来自药监机构及新药研发企业公开披露的信息,包括注册申报、临床登记、新闻资讯、上市公告、文献、专利等。
医药魔方PharmaGo基础数据库是医药魔方推出的一站式医药数据仓库,整合了包括药品注册申报、原辅包备案、中国临床试验、全球临床试验、中国参比制剂、中美欧日上市药品、中标药品、医保数据、基药数据、年报销售以及批签发数据在内的14个子库资源,使行业竞争情报唾手可得,旨在为客户立项调研、竞品监控、行业研究以及市场准入提供必要支持。
在此报告中,PharmaGo提供了关于中国历年首次IND新药注册申报信息、中国历年创新药临床试验登记适应症与开展情况统计、中国历年NDA产品申报情况统计、药品审评时长统计等多维度信息。



 个人中心
个人中心
 我是园区
我是园区




