
10 月 25 日,据 CDE 官网显示,复星凯特的阿基仑赛注射液新适应症申报上市(受理号:CXSS2200087),拟用于一线免疫化疗无效或在一线免疫化疗后 12 个月内复发的成人大 B 细胞淋巴瘤(r/r LBCL)。
此前 CDE 已于本月 14 日公示,将该适应症纳入优先审评。

来自:CDE 官网
阿基仑赛注射液是复星凯特 2017 年初从美国 Kite(吉利德旗下公司)引进 Yescarta (axicabtagene ciloleucel) 在中国进行技术转移,并获授权在中国进行本地化生产的靶向人 CD19 自体 CAR-T 细胞治疗产品。
据 Insight 数据库显示,Yescarta 早于 2017 年 10 月获 FDA 批准上市,用于三线及三线以上治疗 LBCL 成年患者,是美国 FDA 批准的首款针对特定非霍奇金淋巴瘤的 CAR-T 细胞药物。
Yescarta 全球项目开发关键节点
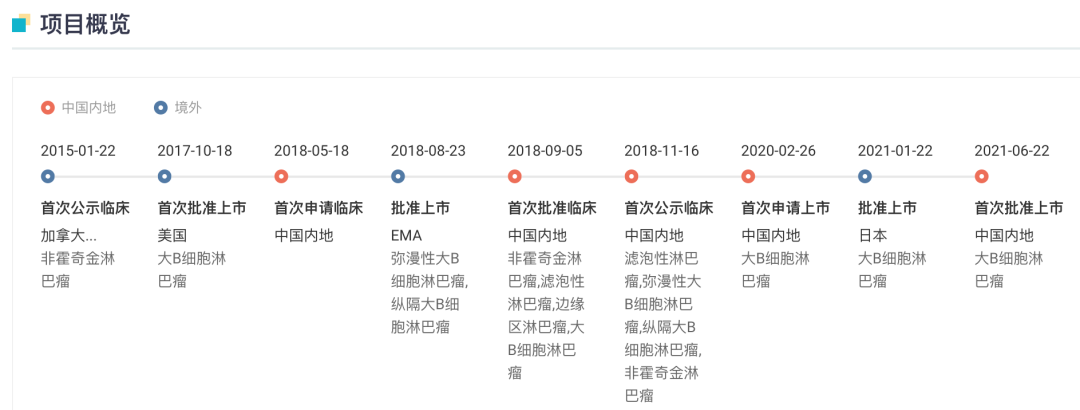
来自:Insight 数据库网页版
2021 年 3 月,其用于治疗复发/难治性滤泡性淋巴瘤(FL)成人患者的扩展适应症申请获得美国 FDA 加速批准,成为全球首个获批上市用于 FL 的 CAR-T 细胞治疗产品。
今年 4 月,Yescarta 进一步拓展新适应症,获批用于二线大 B 细胞淋巴瘤治疗,成为全球首款获 FDA 批准作为二线疗法的 CAR-T 药物。
此次适应症的获批是基于 ZUMA-7 研究(登记号:NCT03391466)的试验结果。ZUMA-7 研究于 2017 年启动,是首个也是规模最大的 CAR-T 细胞疗法用于二线治疗 R/R LBCL 的 3 期随机研究,在全球 77 个中心招募了 359 名患者。
ZUMA-7 试验登记情况
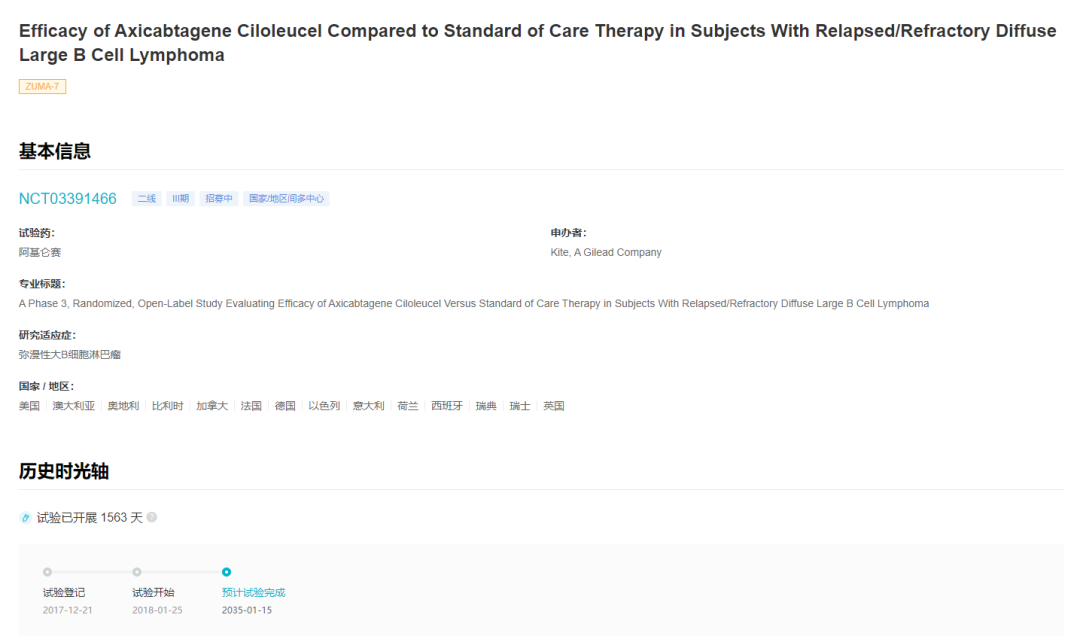
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
此前吉利德曾披露了此项临床试验数据,并同步发表于 NEJM。
中位随访超过两年,该研究达到了无事件生存的主要终点(EFS;风险比 0.398;95% CI:0.308-0.514,P<0.0001)。较之标准疗法(SOC),Yescarta 治疗组两年后存活且不需要额外癌症治疗或发生癌症进展的患者增加了 2.5 倍(40.5% 与 16.3%),中位 EFS 增加了四倍(8.3 个月与 2.0 个月)。
NCT03391466 临床试验结果

来自:Insight 数据库网页版
在国内,阿基仑赛于 2021 年 6 月获批上市(点此回顾审评历程),用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,成为国内首款获批的 CAR-T 疗法,开启了国内细胞治疗元年。
此后,于 2021 年 8 月,其新增适应症纳入突破性治疗药物程序,拟用于治疗接受过二线或以上系统性治疗后复发或难治性惰性非霍奇金淋巴瘤(r/r iNHL),包含滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)。
阿基仑赛国内开发进度甘特图
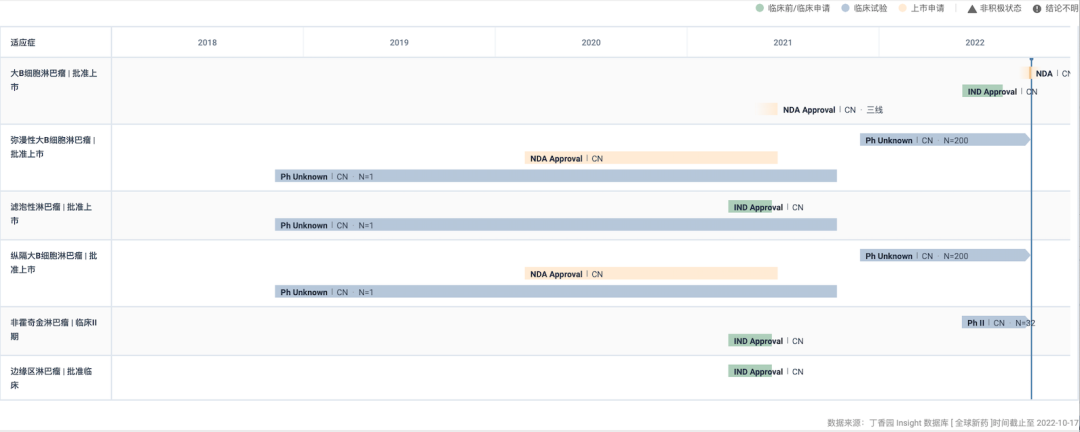
来自:Insight 数据库网页版





 个人中心
个人中心
 我是园区
我是园区




