▎药明康德内容团队报道
10月28日,微芯生物发布公告,其全资子公司微芯药业近日收到中国国家药品监督管理局(NMPA)签发的《药物临床试验批准通知书》,同意1类新药西格列他钠片在2型糖尿病患者中开展与二甲双胍联合用药的临床试验,用于经二甲双胍单药治疗疗效不佳的人群控制血糖。值得一提的是,微芯生物已于2019年9月在中国提交了西格列他钠治疗2型糖尿病的上市申请,有望成为继抗肿瘤新药西达本胺之后该公司第二款上市产品。
根据公告,二甲双胍片是当前各国糖尿病治疗指南推荐的用于治疗2型糖尿病的一线药物,但二甲双胍单药治疗的年失败率达17%,治疗失败的患者需要在二甲双胍的基础上加用其他作用机制互补的药物进行二联甚至三联治疗。
西格列他钠是微芯生物自主设计、合成、筛选和开发的一款核受体过氧化物酶体增生物受体(PPAR)全激活剂,属于全新作用机制的胰岛素增敏剂,用于治疗2型糖尿病。
公告显示,西格列他钠是全球首个完成3期临床试验的PPAR全激动剂。
前期研究中,西格列他钠显示其
对于2型糖尿病患者胰岛素抵抗、血糖、血脂异常等临床治疗的综合改善和良好的安全性
,同时显示出对于胰岛、肝脏等组织器官的保护潜力。这证明西格列他钠在2型糖尿病及其相关并发症上具有进一步临床开发价值,预期将为这类患者带来差异化的治疗新
选择。
根据中国药
物临床试验登记与信息公示平台,西格列他钠已登记完成至少7项临床试验,适应症均为针对糖尿病。其中,包括
治疗2型糖尿病的阳性药对照3期临床试验,及
治疗2型糖尿病的安慰剂对照的3期临床试验。值得一提的是,微芯生物已于2019年9月在中国提交了西格列他钠治疗2型糖尿病的新药上市申请(NDA),目前正在技术审评中。
糖尿病之外,西格列他钠还在临床前研究中展现更广泛的应用前景。它对非酒精性脂肪肝模型具有显著的降低肝组织脂肪变性、炎症浸润和纤维化的药效活性,未来将进一步开展针对非酒精性脂肪性肝炎(NASH)的临床试验研究。
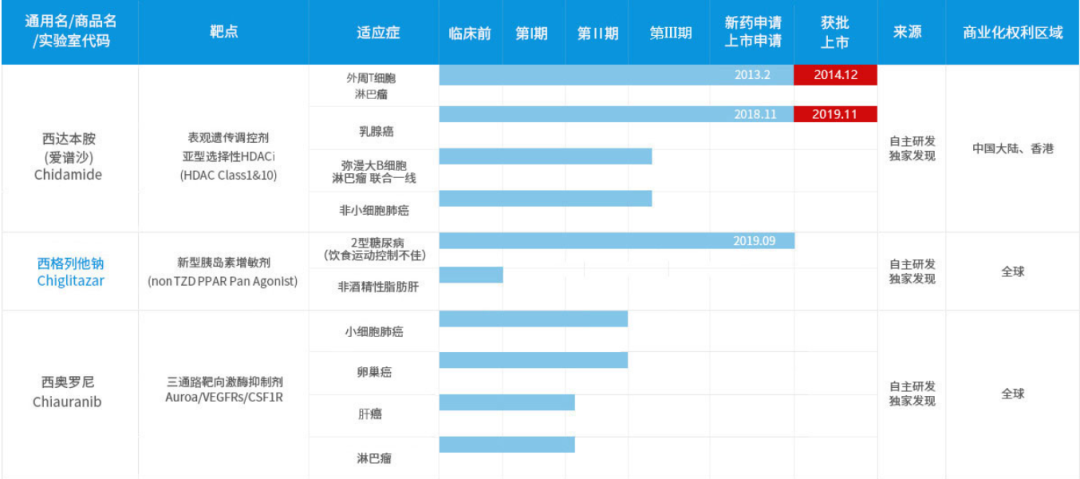
▲
微芯生物部分在研产品(图片来源:微芯生物官网)
微芯生物成立于2001年,专注小分子药物的原创研发。2019年8月,微芯生物在科创板
,成为了首家通过上海证券交易所科创板注册的医药企业。目前,微芯生物已建立了丰富的产品管线。该公司自主研发的西达本胺是全球首个亚型选择性组蛋白去乙酰化酶(HDAC)口服抑制剂,已在中国获批治疗外周T细胞淋巴瘤、乳腺癌适应症。
除了西达本胺和西格列他钠,微芯生物的产品线中还有靶向AuroaB/VEGFRs/CSF1R三通路的激酶抑制剂、JAK3/JAKS/TBK1选择性激酶抑制剂、PD-1/PD-L1拮抗剂等多种产品,覆盖小细胞肺癌、非酒精性脂肪肝、自身免疫性疾病等多种适应症。
祝贺微芯生物西格列他钠获得新的临床试验批准,希望该产品临床开发进展顺利,早日为糖尿病、NASH等患者带来创新疗法。
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。
欢迎扫码关注“
医药观澜
”微信公众号,了解更多中国医药创新动态。

注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]
微芯生物:
关于全资子公司获得临床试验通知书的公告
. Retrieved Oct 28,2020, from
http://www.cninfo.com.cn/new/disclosure/detail?stockCode=688321&announcementId=1208624462&orgId=9900038965&announcementTime=2020-10-28





 药选址
药选址


