
据 Insight 数据库 统计,上周(8 月 15 日-8 月 20 日)全球共有 52 款创新药(含改良新)研发进度推进到了新阶段。早期临床方面,19 款首次获批临床,10 款首次启动临床。从成分类别角度来看,化药、疫苗、干细胞治疗、ADC、基因疗法、双抗、siRNA……百花齐放。
下面,Insight 将分别摘取国内外部分重点项目做介绍。

国内创新药进展
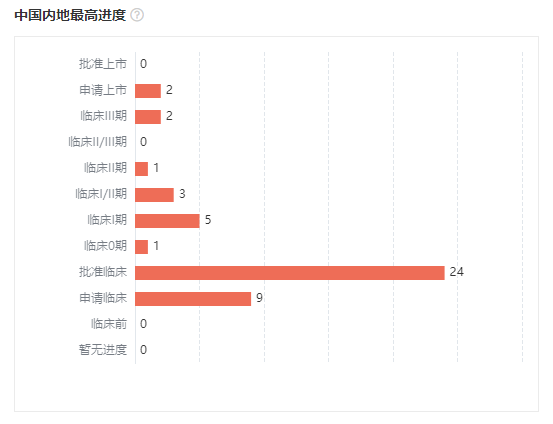
国内方面,上周共有 47 款创新药研发进度推进到了新的阶段。最受关注的是第一三共/阿斯利康重磅炸弹 德曲妥珠单抗(DS-8201,商品名:Enhertu)用于 HER2 低表达乳腺癌的适应症在国内申报上市;此外,又有 2 款创新药推进至 III 期阶段,康方生物还启动了一款双抗药物 AK112 头对头 K 药的 III 期临床。
早期新药进展也是再次爆发。24 款创新药首次获 CDE 批准临床,9 款首次申报临床,5 款首次启动临床。
「德曲妥珠单抗」重磅新适应症报上市
8 月 18 日,据 CDE 官网显示,第一三共递交了「德曲妥珠单抗」新适应症上市申请(受理号:JXSS2200033)。适应症为:既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的,不可切除或转移性 HER2 低表达(IHC 1+ 或 IHC 2+/ISH-)成人乳腺癌。
德曲妥珠单抗即第一三共与阿斯利康合作的重磅 HER2 ADC 药物 Trastuzumab Deruxtecan,今年 3 月 21 日,该药在国内递交首个上市申请,用于既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性成人乳腺癌患者(受理号:JXSS2200011),当前正在审评中。
2019 年 3 月 28 日,阿斯利康与第一三共签订全球合作开发和商业化协议,以首付款 13.5 亿美元 + 潜在里程碑 55.5 亿美元的金额大手笔获得德曲妥珠单抗。两家公司合力推进,使该药不断攀升上新的高度,近期更是直接进入了爆发期:
6 月初,两家公司在 2022ASCO 大会上披露了 DESTINY-Breast04 研究(简称 DB04),技惊四座;6 月末到 7 月,又陆续在欧盟、日本和美国递交了针对 HER2 低表达乳腺癌的新适应症上市申请。FDA 在申报仅仅两个星期内就迅速给出积极结果,批准该适应症在美国上市;8 月 11 日,德曲妥珠单抗首个非小细胞肺癌适应症又在美国获批,这使 Enhertu 成为非小细胞肺癌首个、也是当前唯一获批上市的 ADC 药物。
Enhertu 近期申报/获批的适应症
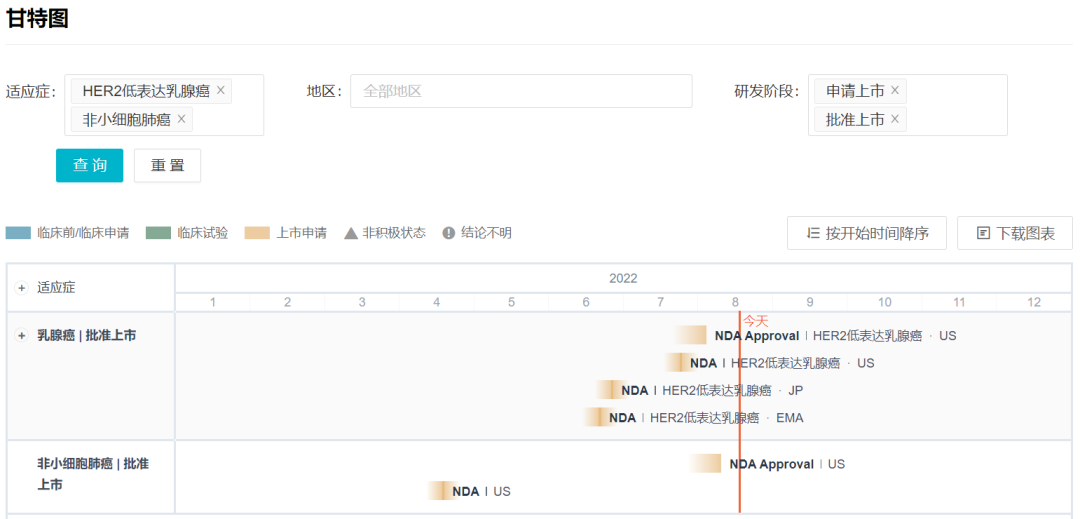
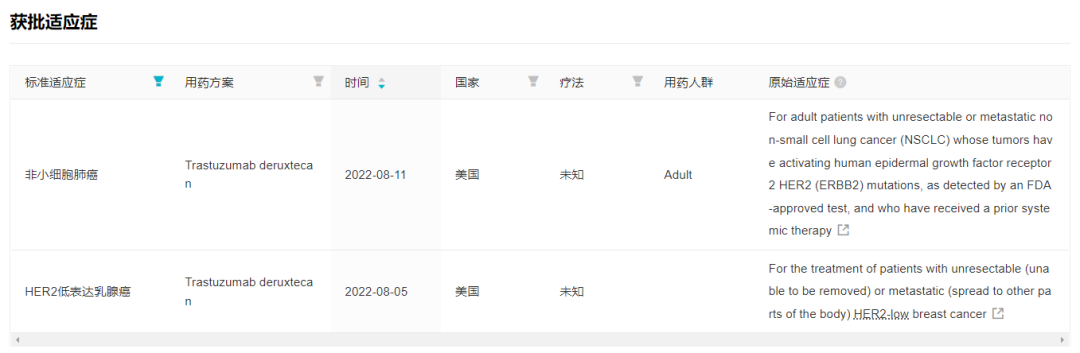
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
本次国内上市申请同样是基于 DB04 研究,其临床数据如下(图片可放大查看):
DB04 临床试验数据
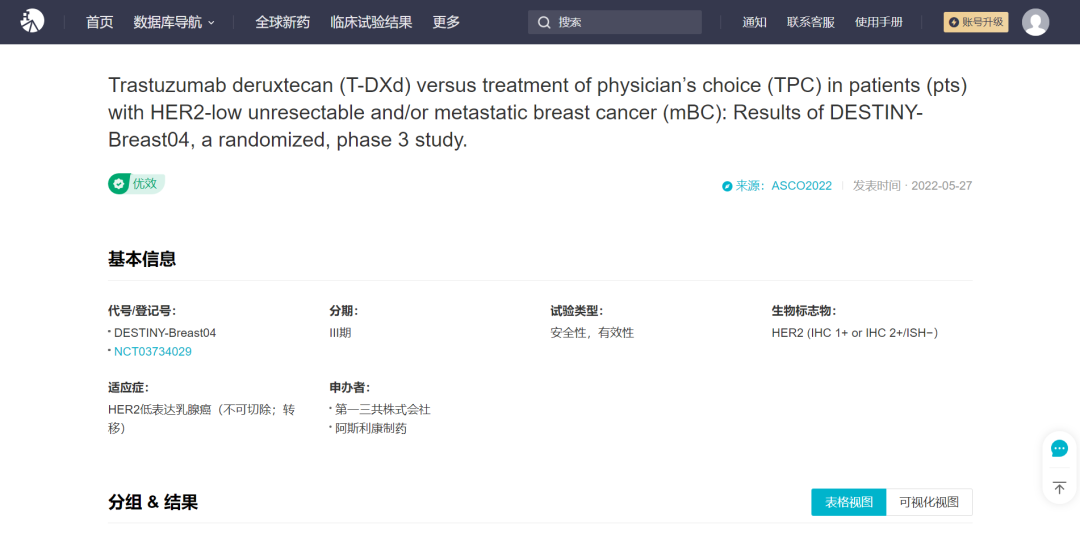
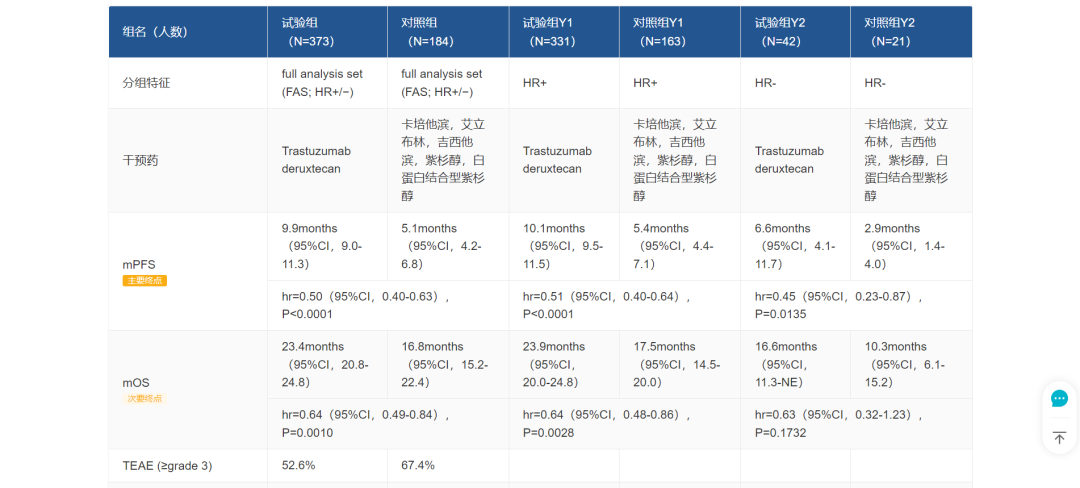
来自:Insight 数据库网页版
据阿斯利康资料,在乳腺癌患者中约 20% 患者为 HER2 阳性(IHC 3+),50% 的患者为 HER2 低表达(IHC 2+/IHC 1+),15-30% 的患者 HER2 极低表达(0 < IHC < 1+),5 - 20% 的患者为 HER2 阴性。
乳腺癌中的 HER2 表达
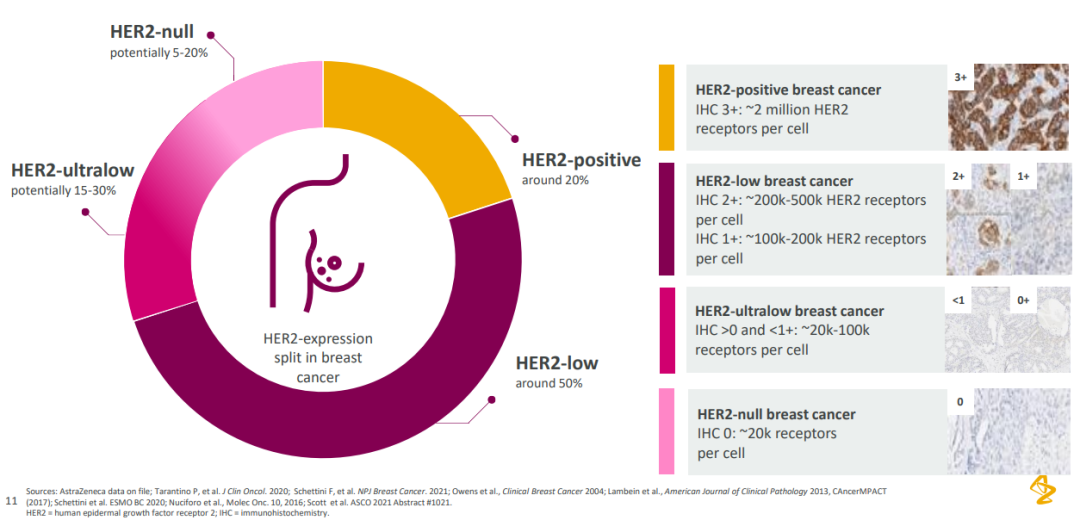
来自:阿斯利康 2022 ASCO 资料
以往的 HER2 标准疗法仅能覆盖到 HER2 阳性患者,而 Enhertu 将适应症拓展到 HER2 低表达人群之后,意味着乳腺癌领域约 50% 此前不能在 HER2 靶向疗法中获益的患者从此有了新的治疗方案。
启动 III 期临床新药
1、恒瑞医药:HR20013
8 月 17 日,恒瑞医药的 1 类新药 HR20013 首次公示启动 III 期临床(登记号:CTR20222107),离上市又近一步。HR20013 的在研适应症为:预防高致吐性化疗引起的恶心呕吐。
这是一项多中心、随机、双盲双模拟、阳性对照 III 期临床研究,拟在国内 67 家医疗机构纳入 752 例患者,由中山大学肿瘤防治中心的张力教授主导,试验方案编号 HR20013-301。试验以注射用福沙匹坦双葡甲胺联合盐酸帕洛诺司琼为对照,评价 HR20013 的有效性和安全性。
临床试验基本信息和时光轴
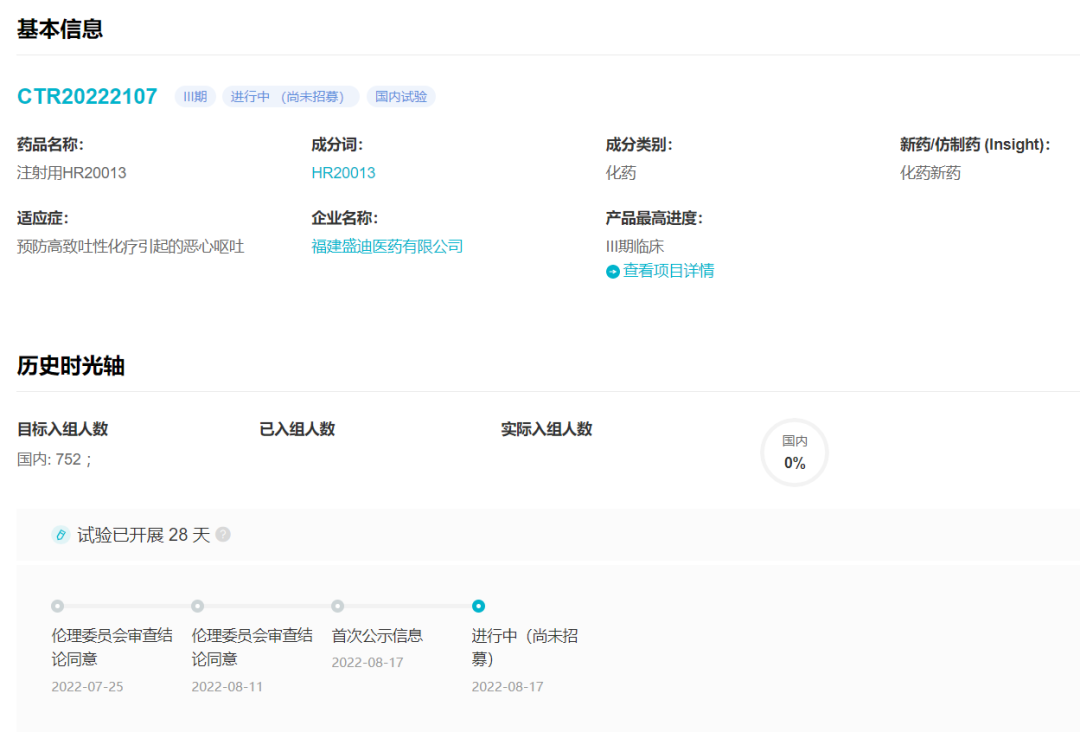
来自:Insight 数据库网页版
据 Insight 数据库显示,HR20013 最早在 2021 年 4 月首次在国内申请临床,同年 9 月启动 I 期临床,仅仅时隔不到一年就推进到 III 期临床阶段,进度相当快。
HR20013 研发进度甘特图
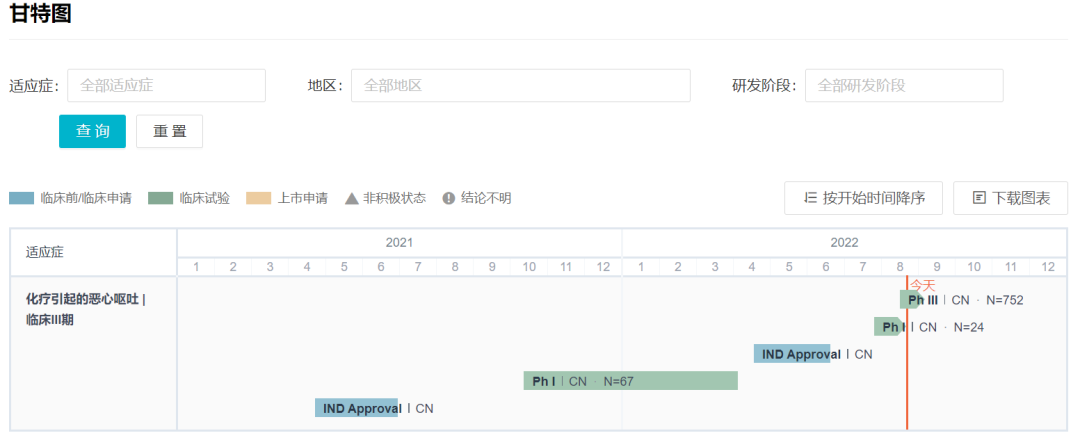
来自:Insight 数据库网页版
2、康方生物:AK112 头对头挑战 K 药
据 Insight 数据库显示,近日康方生物在 ClinicalTrials.gov 上登记了一项随机对照的多中心 III 期临床研究(登记号:NCT05499390),旨在评估 AK112 对比 K 药帕博利珠单抗一线治疗 PD-L1 阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者的疗效和安全性。
NCT05499390 临床试验历史时光轴
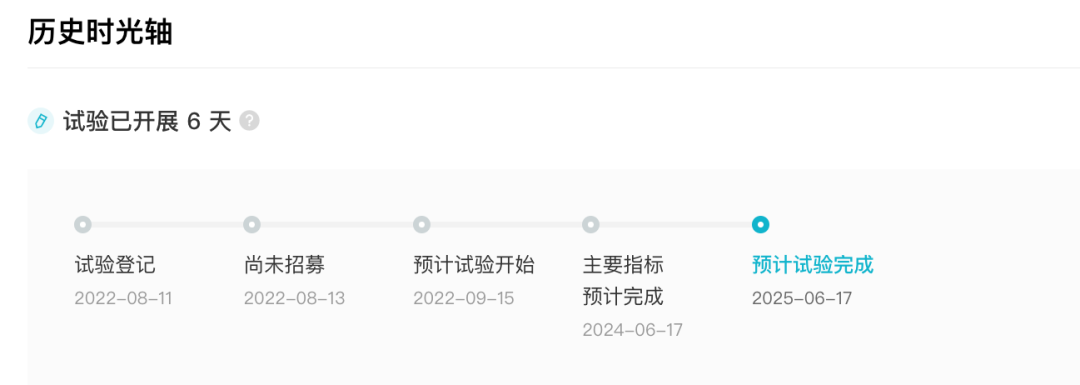
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
该研究计划纳入 388 名受试者,随机分组接受 AK112(静脉注射)和 K 药(每三周静脉注射 200 mg)治疗。主要终点是独立影像评估委员会(IRRC)按照 RECIST v1.1 标准评估的无进展生存期(PFS),次要终点包括总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DoR)等。
NCT05499390 临床试验
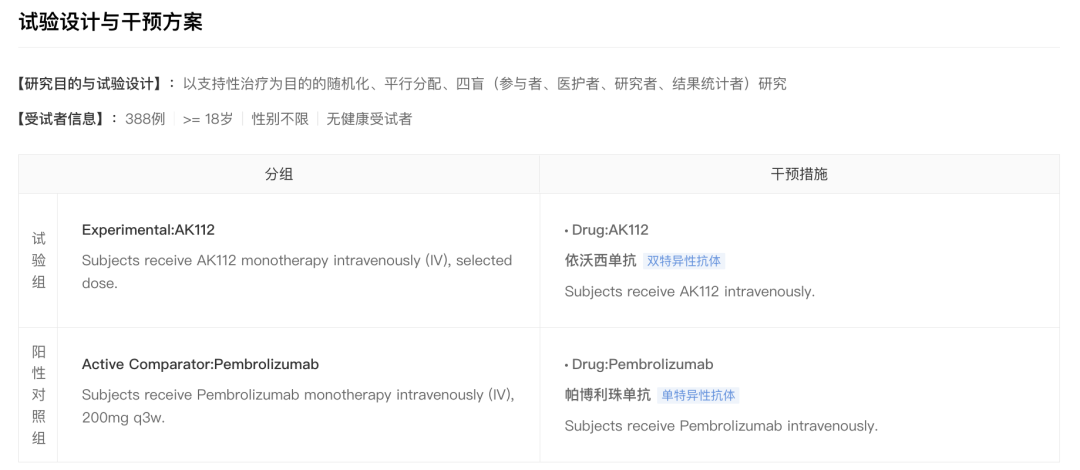
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
AK112(Ivonescimab)是康方生物自主研发的全球首个进入临床研究的 PD-1/VEGF 双特异性抗体,基于康方生物 Tetrabody 技术设计,可阻断 PD-1 与 PD-L1 和 PD-L2 的结合,并同时阻断 VEGF 与 VEGF 受体的结合。PD-1 抗体与 VEGF 阻断剂的联合疗法已在多种瘤种(如肾细胞癌、非小细胞肺癌和肝细胞癌)中显示出强大的疗效。鉴于 VEGF 和 PD-1 在肿瘤微环境中的共表达,与联合疗法相比,AK112 作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。
除非小细胞肺癌外,据数据库显示,目前 AK112 正在全球开展针对结直肠癌、卵巢癌、宫颈癌等多个癌种的临床试验。
AK112 全球在研进度

来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
首次启动临床新药
1、百奥泰新一代 HER2 ADC:BAT8010
8 月 19 日,据 Insight 数据库显示,百奥泰在研新药 HER2 ADC BAT8010 启动 I 期临床试验。
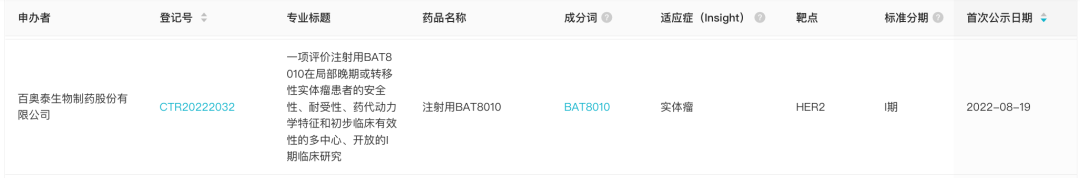
来自:Insight 数据库网页版
这是一项评价注射用 BAT8010 在局部晚期或转移性实体瘤患者的安全性、耐受性、药代动力学特征和初步临床有效性的多中心、开放的 I 期临床研究(登记号:CTR20222032)。目标入组人数为 109 人。
CTR20222032 临床试验信息

来自:Insight 数据库网页版(点击放大,查看大图)
据 Insight 数据库显示,目前百奥泰在研 ADC 管线包括 5 款,前两款基于旧有 ADC 平台,已经终止,另外 3 款均处于 I 期临床阶段。此外,百奥泰后续还申报了另两款新药 BAT8007 和 BAT8008,虽未公布靶点,根据既往命名规则,大概率也是 ADC 新药。
百奥泰在研 ADC 管线
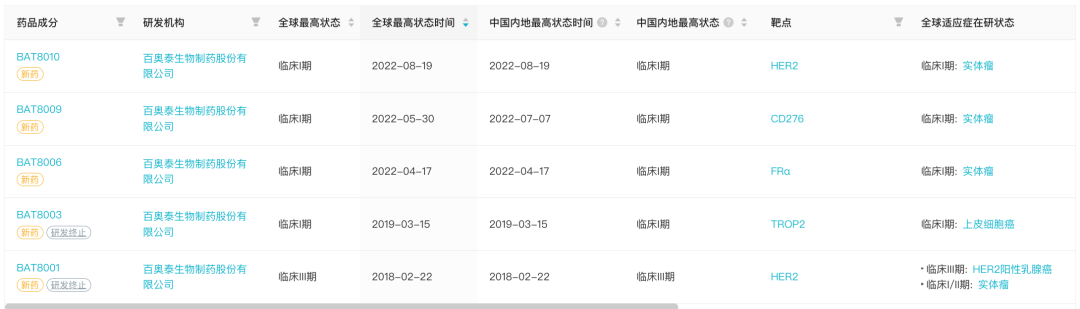
来自:Insight 数据库网页版
百奥泰在去年 3 月曾经终止已经处于 III 期临床开发中的同靶点 ADC 药物 BAT8001,在当时引起热议。但百奥泰并未止步于此,而是自主研发了新的 ADC 平台,继续开发 ADC 新药。
本次开发的 BAT8010 相较于 BAT8001,在毒素、连接子等方面均有区别。BAT8010 对标 Enhertu,采用可剪切的连接子,毒素采用拓扑异构酶 I 抑制剂,同时具有旁观者效应,能够杀伤附近癌细胞,克服肿瘤细胞异质性。
2、和誉医药 PD-L1 小分子抑制剂:ABSK043
8 月 19 日,和誉医药首次在国内启动了 PD-L1 小分子抑制剂 ABSK043 的临床试验(登记号:CTR20222079)。此前在去年 6 月,这款药物已经在澳大利亚启动了 I 期临床
。
据和誉医药新闻稿,ABSK043 是一款全新的口服和具备优异活性及选择性的小分子 PD-L1 抑制剂,可与 PD-L1 特异性结合并诱导其从细胞表面内吞,有效地抑制 PD-1/PD-L1 的相互作用,恢复 PD-L1 介导的 T 细胞活化抑制。该药已在多个临床前模型中展现出与已获批 PD-L1 抗体相当的强大抗肿瘤功效。
和誉医药的肿瘤免疫管线主要聚焦在小分子领域,靶点布局覆盖了 CSF-1R、CXCR4、PD-L1、CD73 和 RORγt。相较于内卷严重的抗体药领域,小分子肿瘤免疫药物的竞争相对缓和,或许代表着更多机会。
1、双抗 ADC:康方生物 HER2 新药申报临床
8 月
16 日,CDE 官网显示,康宁杰瑞 JSKN-003 首次在国内申报临床(受理号:CXSL2200376)。JSKN-003 是一款靶向 HER2 双表位的 ADC 药物,8 月份刚刚在海外启动了 I 期临床。
JSKN003 基于 HER2 双特异性抗体 KN026 开发,靶向 HER2 不同表位,DAR 为 3-4。康宁杰瑞表示,为加速产品上市,优先开发针对 HER2 表达的末线泛实体瘤,8 月 4 日该公司在 ClinicalTrials.gov 上登记了 JSKN003 的 I 期首次人体试验
(登记号:NCT05494918)
,计划入组 48 位 HER2 表达的晚期或转移性实体瘤患者。
据康宁杰瑞资料,JSKN003 在 HER2 高表达和低表达细胞(CDX+PDX 模型)中均显示出相较 DS8201 的可比活性,且具有更好的血清稳定性和潜在更优的安全性。
当前,全球进展最快的 HER2 双抗 ADC 是 Zymeworks 公司的 ZW49(临床 I 期)。和康宁杰瑞一样,该公司也同样拥有一款快速推进的 HER2 双抗 ZW25(临床 III 期)。
国内合作伙伴为百济神州,两家公司在 2018 年 11 月达成合作
。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
在 HER2 双抗产品组合的开发中,康宁杰瑞是全球仅次于 Zymeworks 的企业,双抗 KN026(Anbenitamab)也进入临床 II/III 期开发阶段,国内联手石药集团共同开发。除康宁杰瑞外,国内同领域布局企业还包括正大天晴(TQB2930)、四环医药(KM257)、天广实(MBS301)等。
康宁杰瑞建立了多个创新技术平台,包括 Treg 调节抗体、免疫调节多功能抗体(TIMC)、糖免疫调节抗体(GIMC)、趋化因子偶联抗体(CIMC)等,平台及代表性药物详见下图:
8 月 17 日,君实生物宣布公司自主研发的重组人源化抗 DKK1 单克隆抗体注射液 JS015 在国内递交临床申请获得 CDE 受理(受理号:CXSL2200380)。拟研发适应症为:晚期恶性实体瘤。
DKK1 (Dickkopf-1) 是 DKK 家族的一种分泌型蛋白,高表达于多发性胃癌、胃食管交界处癌、骨髓瘤、肝癌、肺癌、卵巢癌等多种肿瘤细胞,能通过负反馈信号抑制经典的 Wnt 信号通路。
JS015 能以高亲和力结合人 DKK1,而且能够有效阻断 DKK1 与其配体 LRP5/6 的相互作用,激活 Wnt 信号通路。同时,JS015 能够抑制 DKK1 在肿瘤微环境中的免疫抑制作用,增强免疫系统杀伤肿瘤细胞的能力。
临床前体内药效研究表明,JS015 单药、联合本公司商业化产品特瑞普利单抗注射液(商品名:拓益®,产品代号:JS001)或联合紫杉醇均具有显著的抑瘤效果。此外,动物对 JS015 的耐受性良好。
据 Insight 数据库显示,当前全球范围内共 5 款 DKK1 靶点新药在研,其中 4 款为单抗。在君实生物此次临床申报之前,国内尚无企业申报同靶点药物;不过,2020 年 1 月百济神州曾与 Leap Therapeutics 达成合作获得同靶点单抗 DKN-01 在除日本外的亚洲地区、澳大利亚和新西兰独家权益的选择权。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
境外方面,上周共有 20 款创新药研发进度推进到了新的阶段。
最受关注的是蓝鸟生物基因疗法 Zynteglo 在美国批准上市,它刷新了诺华 Zolgensma 的记录,成为了新晋「全球最贵药物」;此外,多项交易引人瞩目。
280 万美元一针:Zynteglo 在美国获批上市
8 月 17 日,据 FDA 官网显示,蓝鸟生物(bluebird bio)基因疗法 beti-cel 获 FDA 批准上市,用于治疗需要定期输血的成人和儿童 β-地中海贫血患者,单次治疗费用为 280 万美元,超过诺华基因疗法 Zolgensma 212.5 万美元的定位,成为「全球最贵药物」。
beti-cel 是美国首个获批的针对 β-地中海贫血患者潜在遗传病因的一次性疗法,将为患者提供常规红细胞输注和铁螯合剂治疗以外的替代方案。
该疗法的获批是基于多项 III 期研究的阳性数据,研究发现,89% (32/36) 所有年龄和基因型的可评估患者(包括年仅 4 岁的儿童和最严重基因型 (β0/β0) 患者)均实现了输血独立(至少 12 个月不再需要 RBC 输注,同时保持至少 9g/dL平均 Hb 水平)。
本次在美国获批上市商品名为 Zynteglo,与此前在欧洲上市时商品名一致。据 Insight数据库 显示,beti-cel 在 2019 年 5 月在欧盟获批上市,不过 2021 年 4 月蓝鸟生物已经宣布从德国撤市,后续投资者交流中又表示将在 2022 年初从欧洲市场撤出,原因与定价相关。
beti-cel 的临床开发跨越近 10 年,该药在美国的审评延迟并非来自于安全性问题,而是由于 CMC 问题。ICER 在今年早些时候曾给出了积极评价,认为若以 210 万美元定价,该疗法具有成本效益,毕竟相较于持续输血治疗,基因疗法是一种一次性治疗方案。因此,此前业内对该药前景的推测更加积极。
而本次确定定价为 280 万美元,更是彰显其在临床研究中证明的强大而持续的临床益处,以及其在减轻与定期 RBC 输血和铁管理相关的终生医疗保健成本方面的潜力。
1、超 6 亿美元!济民可信创新口服 AR 降解剂独家授权罗氏
8 月 18 日,罗氏宣布其及旗下基因泰克与济民可信集团及旗下子公司上海济煜医药科技有限公司(以下简称「上海济煜」)达成一项独家许可协议。
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
上海济煜将具有自主知识产权的口服雄激素受体(AR)降解剂 JMKX002992 在全球的开发及商业化权利独家许可给基因泰克。这是罗氏及旗下基因泰克首次从中国创新药企获得在全球开发和商业化潜在药物的独家许可权利。
根据协议,基因泰克将获得 JMKX002992 在全球范围的独家开发及商业化权利,并承担全部的开发及商业化费用。作为回报,基因泰克将向上海济煜支付 6000 万美元首付款,并在达到协议约定的里程碑时支付相应的开发和商业化里程碑款项,里程碑款项最高可达 5.9 亿美元。此外,上海济煜还将获得合作产品基于净销售额的梯度提成。
JMKX002992 是由上海济煜小分子创新研究院自主研发的一款全新口服 AR 降解剂,雄激素受体是公认的前列腺癌疾病驱动因素,JMKX002992 对于对现有疗法耐药的前列腺癌患者具有治疗潜力。
8 月 16 日,
默沙东
宣布与 Orna Therapeutics 公司达成
合作,共同发现和开发基于环状 RNA(circular RNA)的多个研发项目,包括在传染病和肿瘤学领域的疫苗和疗法。
根据协议条款,默沙东将向 Orna 支付 1.5 亿美元的预付款,这笔款项将由默克在 2022 年第三季度支出。此外,Orna 将有资格获得高达 35 亿美元的与多个疫苗和治疗计划进展相关的开发、监管和销售里程碑付款,以及从合作中获得的任何获批产品的特许权使用费。
Orna 将保留其 oRNA-LNP 技术平台的权利,并将继续推进肿瘤学和遗传疾病等领域的其他全资项目。默沙东还将在 Orna 最近完成的 B 轮融资中投资 1 亿美元股权。
3、30.67 亿元!云顶新耀「退货」吉利德 TROP-2 ADC
8 月 15 日,云顶新耀宣布与吉利德子公司 Immunomedics 订立终止及过渡服务协议,转让此前引进自 Immunomedics 的 TROP-2 ADC 药物 Trodelvy(拓达维®)的亚洲权益。
根据该协议,云顶新耀将获得总额 4.55 亿美元的对价,其中包括预付款 2.8 亿美元
(需获得相关监管部门的批准)
和未来潜在的里程碑付款 1.75 亿美元;此外,云顶新耀将无需再支付此前 License-in 交易当中的剩余高限里程碑付款 7.1 亿美元。
* 权益地区包括:大中华区、韩国、新加坡、印度尼西亚、菲律宾、越南、泰国、马来西亚和蒙古国
云顶新耀与 Immunomedics 的交易最初发生在 2019 年 4 月,以 6500 万美元首付款 + 潜在 7.7 亿美元里程碑付款 + 特许权使用费获得了 Trodelvy 在除日本外亚洲地区的权益。该笔交易
早于该公司被吉利德收购,次年 Immunomedics 就以 210 亿美元「卖身」成为吉利德子公司。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
合作期间,云顶新耀已经成功将 Trodelvy 在中国内地和新加坡两地推动上市,并向韩国、中国台湾地区、香港地区的药监机构递交了上市许可申请。本次终止协议达成之后,吉利德将回收并重新掌握 Trodelvy 的全球权益,而云顶新耀则获得一笔资金,
加强公司财务状况、优化资源,以进一步发展研发管线中其他同类首创和同类领先的候选药物。
免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
免费试用 Insight 数据库





































 个人中心
个人中心
 我是园区
我是园区




