▎药明康德内容团队编辑
2021年10月14日,再生元(Regeneron)公司宣布,美国FDA已授予其中和抗体组合疗法REGEN-COV(casirivimab+imdevimab)的生物制品许可申请(BLA)优先审评资格,用于治疗非住院COVID-19患者,并作为高风险人群的暴露后预防(post-exposure prophylaxis)疗法。新闻稿指出,如果获得批准,它将是美国FDA正式批准的首个同时用于治疗COVID-19患者和作为暴露后预防疗法的新冠中和抗体。

REGEN-COV是两种单克隆抗体的混合物,专门设计用于阻断导致COVID-19的新冠病毒的传播。这两种中和抗体能以非竞争性方式与病毒刺突蛋白的关键受体结合域结合,从而降低突变病毒逃逸治疗的能力,并防止人体免受病毒突变体侵袭。多项分析表明,这种中和抗体疗法保留了针对主要关注变体的效力,包括Delta、Gamma、Beta和Mu变体。
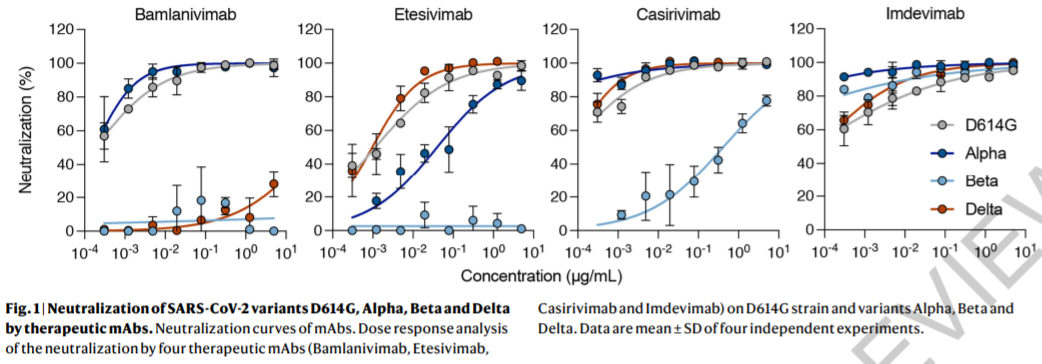
▲Casirivimab和imdevimab对Delta等新冠病毒变种仍然保持中和能力(图片来源:参考资料[3])
本次申请得到两项3期临床试验获得的积极数据支持。2项试验共入组6000多例患者,评估了REGEN-COV治疗感染新冠病毒的非住院患者的有效性和安全性,以及用于预防无症状新冠病毒感染者的家庭接触者(包括未感染和已感染接触者)的症状性感染的效果。
之前发表在
上的一项研究结果显示,对于感染者的家庭接触者,皮下注射REGEN-COV可预防81.4%的有症状感染,和预防66.4%的所有感染。而且,REGEN-COV还减少了症状和高病毒载量的持续时间。
需要注意的是,FDA指出,REGEN-COV并不能代替新冠疫苗接种,并且只能用于成人和儿童个体(12岁以上,体重至少40公斤)的暴露后预防。其最常见的副作用是注射部位反应,至少有1% 的受试者发生导致瘙痒的皮肤发红,以及瘀斑,但没有出现严重的过敏反应或可能危及生命的过敏反应。
罗氏已经与再生元达成合作,主要负责这款中和抗体疗法在美国以外地区的开发和推广。两家公司表示将与公共卫生组织合作,支持向低中收入国家提供这一创新疗法。
自新冠疫情爆发以来,面对这一影响全球的健康危机,全球医药产业也快速做出回应,疫苗、中和抗体、小分子疗法等多种预防和治疗手段的开发,有效遏制了疫情的扩展。这一中和抗体有望为人们提供新的预防和治疗选择。
参考资料:
[1] FDA Accepts REGEN-COV® (casirivimab and imdevimab) for Priority Review for Treatment and Prophylaxis of COVID-19. Retrieved October 14, 2021, from https://www.prnewswire.com/news-releases/fda-accepts-regen-cov-casirivimab-and-imdevimab-for-priority-review-for-treatment-and-prophylaxis-of-covid-19-301400260.html
[2] FDA authorizes REGEN-COV monoclonal antibody therapy for post-exposure prophylaxis (prevention) for COVID-19. Retrieved October 14, 2021, from https://www.fda.gov/drugs/drug-safety-and-availability/fda-authorizes-regen-cov-monoclonal-antibody-therapy-post-exposure-prophylaxis-prevention-covid-19
[3] Planas et al., (2021). Reduced sensitivity of SARS-CoV-2 variant Delta to antibody neutralization. Nature, https://doi.org/10.1038/s41586-021-03777-9
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。







 个人中心
个人中心
 我是园区
我是园区




