NSCLC 术后辅助疗法,奥希替尼新适应症正式获批
收藏
关键词:
疗法适应症获批
资讯来源:Insight数据库 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2021-04-14
4 月 12 日,国家药监局发布药品批准证明文件,其中阿斯利康制药的甲磺酸奥希替尼片新适应症正式获批,用于EGFR 敏感突变的非小细胞肺癌(NSCLC)成人患者肿瘤切除术后的辅助治疗。
甲磺酸奥希替尼片是一种不可逆的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),可同时抑制 EGFR 敏感突变和 EGFR-T790M 耐药突变,并对中枢神经系统转移病灶有临床疗效。
2017 年 3 月,奥希替尼在国内首次获批,用于一代/二代 EGFR-TKI 治疗后出现疾病进展,且 EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者;2019 年 9 月又获批用于用于 EGFR 外显子 19 缺失或外显子 21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。在 2020 年医保谈判中,上述两项适应证全部纳入新版医保目录乙类,患者可及性进一步提高。
2020 年 12 月,美国 FDA 批准奥希替尼用于早期 EGFR 突变型肺癌患者的辅助治疗,这一批准是基于 ADAURA III 期临床试验的结果,结果显示,泰瑞沙可将疾病复发或者死亡风险降低了 80%。
ADAURA 是一项随机、双盲、安慰剂对照的全球 III 期临床试验,共纳入 682 例接受手术切除的 IB-IIIA 期 EGFR 突变(Del19/L858R)阳性 NSCLC 患者,患者可接受术后辅助化疗,入组后患者随机分为两组,一组接受奥希替尼(80 mg/天)治疗,另一组给予安慰剂,直到疾病复发、治疗 3 年完成或符合其它停药标准。研究主要终点为 II-IIIA 期患者的 DFS,次要终点为总人群的 DFS,2 年、3 年、4 年和 5 年的 DFS 率,以及总生存期(OS)、治疗安全性和患者生活质量。
在 II-IIIA 期患者中与安慰剂组相比,奥希替尼组患者疾病复发或死亡的风险降低 83%(HR= 0.17;95%CI:0.12-0.23;p <0.0001)。在 IB-IIIA 期患者的全部试验人群中的 DFS 结果显示,奥希替尼将疾病复发或死亡的风险降低了 80%(HR 0.20;95%CI 0.15-0.27;p <0.0001)。两年后,接受奥西替尼治疗的患者 DFS 率为 89%,而接受标准护理也就是手术后接受安慰剂治疗的患者中 DFS 率只有 52%。奥希替尼在该试验中的安全性和耐受性与以前报导一致。
根据阿斯利康财报,2020 年奥希替尼全球销售额继续保持高增长达到 42.4 亿美元,较 2019 年增长 36%,成为企业支柱产品。
在中国,基于 ADAURA III 期临床试验,奥希替尼针对早期 EGFR 突变 NSCLC 患者的辅助治疗在 2020 年 9 月上市申请获药审中心承办,10 月就被纳入优先审评,从报上市到获批用时半年左右。
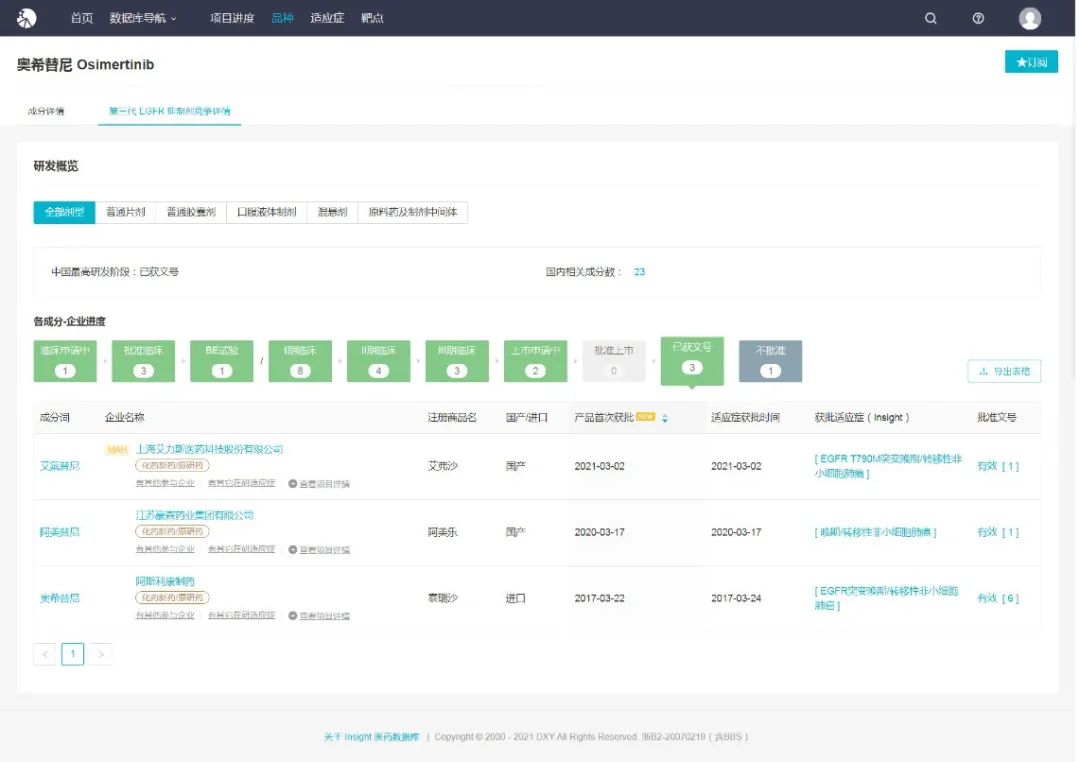
此外值得关注的是,国产三代 EGFR-TKI 也在快速崛起,目前已有豪森的阿美替尼和上海艾力斯的艾氟替尼 2 款国产新药获批,另外还有贝达药业贝福替尼、艾森生物艾维替尼也在上市审评中。
PR 稿对接:请加微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
数据库合作&定制专业报告:
请加微信 yiyaoshujuku001
微信申请试用数据库 30 天






 药选址
药选址




