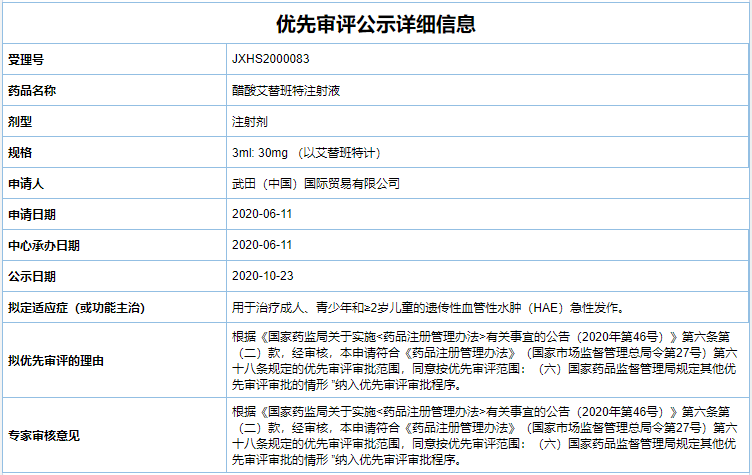
10 月 23 日,CDE 公示更新,拟将武田「醋酸艾替班特注射液」上市申请纳入优先审评审批(受理号:JXHS2000083),适应症为「成人、青少年和 ≥2 岁儿童的遗传性血管性水肿(HAE)急性发作」。该药曾被 CDE 纳入临床急需境外新药名单。当前,国内原研和仿制药均未上市。

艾替班特(Icatibant)由武田旗下夏尔制药(Shire)研发,是一款高选择性缓激肽 B2 受体拮抗剂,通过抑制与遗传性血管水肿的栓塞局部肿胀、炎症、疼痛症状有关的缓激肽的影响,从而治疗急性遗传性血管水肿的栓塞局部肿胀。
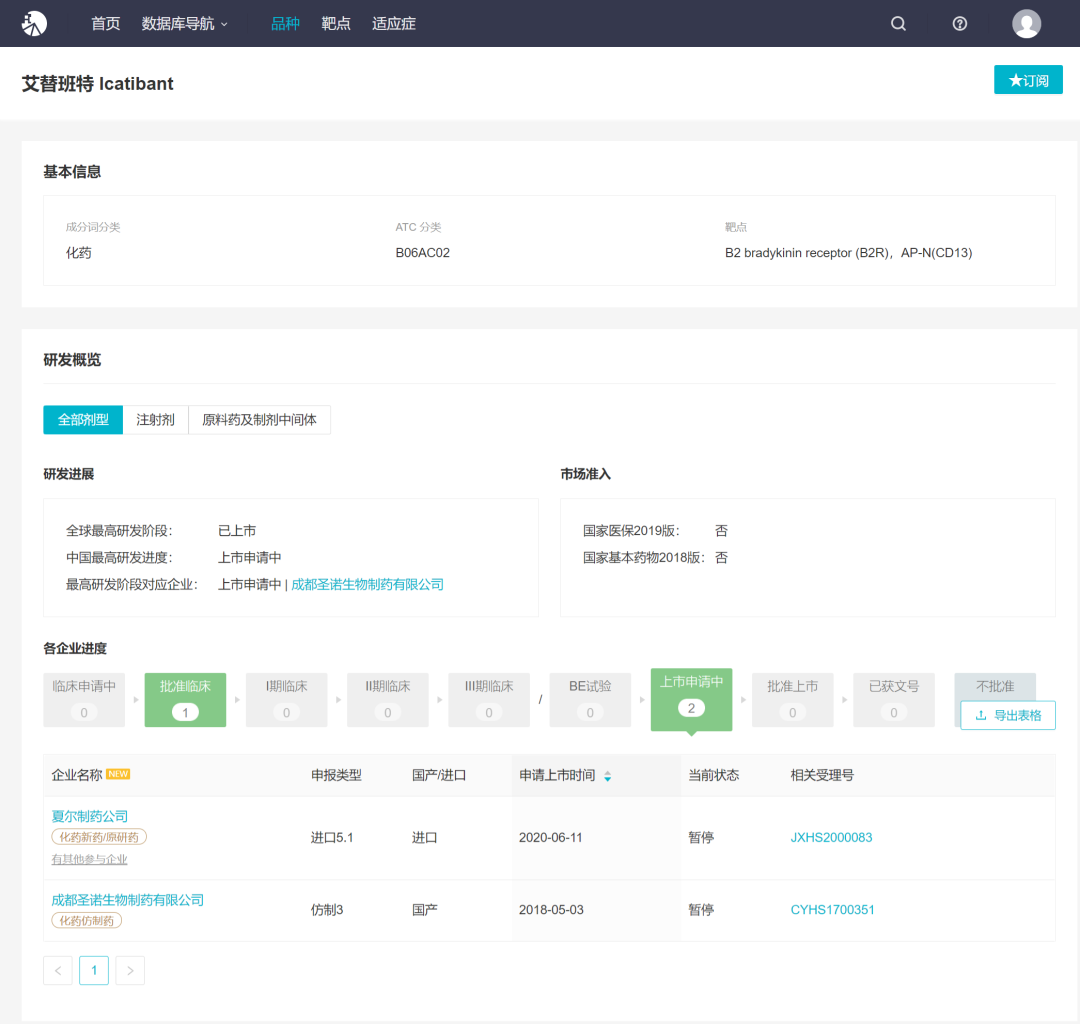
在全球范围内,该药最早于 2008 年 7 月 11 日在欧盟获批上市,并于 2011 年获 FDA 批准上市,成为 FDA 批准的第 3 个遗传性血管水肿治疗药物。而在国内,武田直至 2020 年 6 月 11 日才递交该药上市申请。此前,于 2016 年 2 月,豪森的仿制药曾获批临床;2018 年 5 月,成都圣诺生物提交 3 类仿制药上市申请,当前正处于第一轮补充资料任务中。
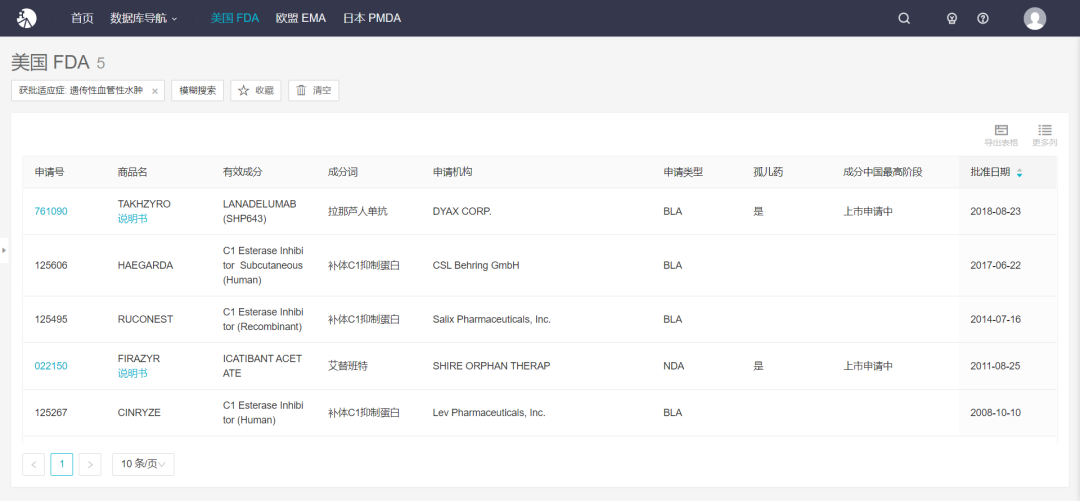
根据 Insight 数据库,另外一款 FDA 批准的遗传性血管水肿预防性治疗药物拉那芦人单抗也已于今年 3 月份在国内提交上市申请。
遗传性血管水肿(HAE)是一种罕见的常染色体显性遗传病,大多数(75%)在 10 ~ 30 岁起病。在临床上,HAE 患者会出现可累及多个解剖学部位(包括胃肠道、面部组织、声带和喉头、口咽、泌尿生殖区域、四肢)的软组织水肿复发性急性发作。其中,喉部发作可因窒息之风险而危及生命,同时,也给患者和家属带来了沉重的经济和精神负担。
2018 年 5 月 11 日,国家卫生健康委员会等 5 部门联合制定了《第一批罕见病目录》,遗传性血管性水肿被收录其中。当前,国内约有 2.8 万患者,患病率约为 1/10,000 ~ 1/50,000。
针对遗传性血管水肿,目前国内仅有达那唑可用于预防性治疗,而尚无有效药物用于急性发作期治疗。本次武田「醋酸艾替班特注射液」上市申请拟纳入优先审评审批,意味着该类患者或将迎来第一款急性治疗药物。



 个人中心
个人中心
 我是园区
我是园区




